题目内容
8.各组性质比较的表示中,正确的是( )| A. | 还原性:HF<HCl<HBr<HI | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 氧化性:F2<Cl2<Br2<I2 | D. | 沸点:Cl2<F2<Br2<I2 |
分析 A.元素的非金属性越强,其简单阴离子的还原性越弱;
B.元素的非金属性越强,其气态氢化物的稳定性越强;
C.元素的非金属性越强,其单质的氧化性越强;
D.卤族元素单质中,单质的熔沸点随着相对分子质量增大而增大.
解答 解:A.元素的非金属性越强,其简单阴离子的还原性越弱,非金属性F>Cl>Br>I,所以还原性:HF<HCl<HBr<HI,故A正确;
B.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性F>Cl>Br>I,所以稳定性HF>HCl>HBr>HI,故B错误;
C.元素的非金属性越强,其单质的氧化性越强,非金属性F>Cl>Br>I,所以氧化性:F2>Cl2>Br2>I2,故C错误;
D.卤族元素单质中,单质的熔沸点随着相对分子质量增大而增大,相对分子质量Cl2<F2<Br2<I2,所以熔沸点Cl2<F2<Br2<I2,故D正确;
故选AD.
点评 本题考查同一主族元素性质递变规律,为高考高频点,明确非金属性强弱与氢化物的稳定性、最高价氧化物的水化物酸性、单质的氧化性、简单阴离子的还原性关系,熟练掌握碱金属族、卤族元素性质递变规律,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
18.下列各组物质中,化学键类型完全相同的是( )
| A. | HI和NaI | B. | H2S和CO2 | C. | Cl2和CCl4 | D. | Na2O2和NaOH |
16.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 100mL 盐酸 | 100mL 盐酸 | 100mL 盐酸 | |
| m(混合物) | 14.2g | 25g | 27.6g |
| V(CO2)(标况) | 3.36L | 4.48L | 4.48L |
| A. | 盐酸的物质的量浓度为3.0mol•L-1 | |
| B. | 加入混合物14.2g时盐酸不足 | |
| C. | 加入25g混合物时盐酸过量 | |
| D. | 根据表中数据计算出混合物中NaHCO3与KHCO3的物质的量之比是1:2 |
3.200℃时,11.6g由CO2和水蒸气的混合物与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
20.一定量的铁粉和9g硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得18g水,求加入的铁粉质量为( )
| A. | 14g | B. | 42g | C. | 56g | D. | 28g |
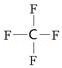
 ,1molO22+中含有的π键数目为2NA.
,1molO22+中含有的π键数目为2NA.