题目内容
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
则2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H= .
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol,且N2占平衡总体积的
.
①则该反应的平衡常数K= .(用只含a、V的式子表示)
②判断该反应达到平衡的标志是
A.v生成(CO2)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态.请在图1中补充画出从t2到t4时刻正反应速率随时间的变化曲线:

(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.
①写出此变化中的总化学反应方程式: .
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.请你判断是否可行并说出理由: .
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
则2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol,且N2占平衡总体积的
| 1 |
| 4 |
①则该反应的平衡常数K=
②判断该反应达到平衡的标志是
A.v生成(CO2)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态.请在图1中补充画出从t2到t4时刻正反应速率随时间的变化曲线:

(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.
①写出此变化中的总化学反应方程式:
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.请你判断是否可行并说出理由:
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)根据盖斯定律来计算化学反应的焓变;
(2)①根据三行式结合化学平衡的移动知识来计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③压缩容器体积,增大了压强,正逆反应速率增大,平衡向着气体体减小的方向移动,据此画出从t2-t3-t4时段,正反应速率的变化曲线;
(3)根据影响化学反应速率的因素以及影响化学平衡移动的因素来回答;
(4)①根据已知信息书写反应物和产物并配平方程式;
②根据反应能否自发进行的判据来回答.
(2)①根据三行式结合化学平衡的移动知识来计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③压缩容器体积,增大了压强,正逆反应速率增大,平衡向着气体体减小的方向移动,据此画出从t2-t3-t4时段,正反应速率的变化曲线;
(3)根据影响化学反应速率的因素以及影响化学平衡移动的因素来回答;
(4)①根据已知信息书写反应物和产物并配平方程式;
②根据反应能否自发进行的判据来回答.
解答:
解:(1)已知①N2(g)+O2(g)=2NO(g)△H=+180.5kJ?mol-l
②C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-l
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-l
依据盖斯定律计算②×2-①-③得到2CO(g)+2NO(g)═N2(g)+2CO2(g))△H=-746KJ/mol;
故答案为:-746.5 kJ/mol;
(2)①2NO(g)+2CO(g)?N2(g)+2CO2(g),
平衡浓度:2a a b 2b
则
=
,解得b=3a
K=
=
,
故答案为:
;
②A.v生成(CO2)=v消耗(CO),不能证明正逆反应速率相等,故A错误;
B.混合气体的密度
,反应前后质量守恒,不变化,体积不变,所以密度始终不变,当密度不变化的状态不一定平衡,故B错误;
C.混合气体的平均相对分子质量=
,质量守恒,但是n变化,当混合气体的平均相对分子质量不再改变,达到了平衡状态,故C正确;
D.NO、CO、N2、CO2的浓度均不再变化是化学平衡的特征,故D正确.
故选CD;
③压缩容器体积,增大了压强,正逆反应速率增大,平衡向着气体体减小的方向移动,即向正方向移动,正反应速率大于逆反应速率,即
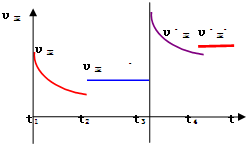 ,故答案为:
,故答案为: ;
;
(3)A.降低温度不会加快反应速率,只能降低反应速率,故A错误;
B.增大压强同时加催化剂,能提高反应的速率和NO的转化率,故B正确;
C.升高温度能提高反应速率,但是充入N2不能提高NO的转化率,故C错误;
D.及时将CO2和N2从反应体系中移走不能提高反应速率,故D错误.
故选B;
(4)①NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为2NO+O2+4CO2NO+O2+4CO
4CO2+N2,故答案为:2NO+O2+4CO
4CO2+N2;
②根据反应能否自发进行的判据,因为△H>0,△S<0,此时△H-T△S>0,在任何情况下都不能自发进行,故答案为:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行.
②C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-l
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-l
依据盖斯定律计算②×2-①-③得到2CO(g)+2NO(g)═N2(g)+2CO2(g))△H=-746KJ/mol;
故答案为:-746.5 kJ/mol;
(2)①2NO(g)+2CO(g)?N2(g)+2CO2(g),
平衡浓度:2a a b 2b
则
| b |
| a+2a+b+2b |
| 1 |
| 4 |
K=
(
| ||||
(
|
| 27V |
| a |
故答案为:
| 27V |
| a |
②A.v生成(CO2)=v消耗(CO),不能证明正逆反应速率相等,故A错误;
B.混合气体的密度
| m |
| V |
C.混合气体的平均相对分子质量=
| m |
| n |
D.NO、CO、N2、CO2的浓度均不再变化是化学平衡的特征,故D正确.
故选CD;
③压缩容器体积,增大了压强,正逆反应速率增大,平衡向着气体体减小的方向移动,即向正方向移动,正反应速率大于逆反应速率,即
 ,故答案为:
,故答案为: ;
;(3)A.降低温度不会加快反应速率,只能降低反应速率,故A错误;
B.增大压强同时加催化剂,能提高反应的速率和NO的转化率,故B正确;
C.升高温度能提高反应速率,但是充入N2不能提高NO的转化率,故C错误;
D.及时将CO2和N2从反应体系中移走不能提高反应速率,故D错误.
故选B;
(4)①NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为2NO+O2+4CO2NO+O2+4CO
| ||
| ||
②根据反应能否自发进行的判据,因为△H>0,△S<0,此时△H-T△S>0,在任何情况下都不能自发进行,故答案为:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行.
点评:本题涉及热化学盖斯定律的应用、化学平衡的有关计算、化学平衡状态的判断等方面的知识,属于综合知识的考查题,难度大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知H2R是一种二元弱酸,有下列反应式:①HR-+H2O?H2R+OH-②HR-+H2O?R2-+H3O+ ③HR-+OH-=R2-+H2O ④HR-+H3O+=H2R+H2O上述反应式按水解、电离、“中和”、复分解的顺序排列的是( )
| A、①②③④ | B、②①③④ |
| C、②①④③ | D、④②①③ |
2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料.下列关于聚乙炔的叙述错误的是( )
| A、聚乙炔是以乙炔为单体发生加聚反应形成的高聚物 |
B、聚乙炔的化学式为 分子中所有碳原子不可能在同一直线上 分子中所有碳原子不可能在同一直线上 |
| C、聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 |
| D、聚乙炔树脂不加任何填充物即可成为电的良导体 |
甲、乙为单质,丙、丁为氧化物,它们存在如图转化关系.则甲和乙不可以是( )


| A、碳和硅 | B、镁和碳 |
| C、钠和氢气 | D、铝和铁 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1mol铁与足量氯气完全反应转移的电子数目为2NA |
| B、常温常压下,1 mol甲基(-CH3)所含的电子数为9NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、用含4molHCl的浓盐酸与足量MnO2加热反应,产生Cl2的分子数为NA |
下列说法正确的是( )
| A、在水溶液中有H+电离的化合物一定属于酸 |
| B、CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
| C、Na2O、Na2O2均属于碱性氧化物 |
| D、有发光、发热、变色、生成气体或沉淀、爆炸等现象的不一定是化学变化 |

 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表: