题目内容
明矾石的主要成分是K2SO4?Al2(SO4)3?2Al2O3?6H2O,此外还含有少量Fe2O3杂质.利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
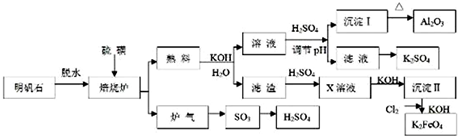
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 .

(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为
(2)生成沉淀Ⅰ时的离子方程式为
(3)写出化学式:沉淀Ⅱ是
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是
(5)从滤液中得到K2SO4晶体的方法是
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成102gAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)分析流程结合氧化铝的性质可知,沉淀Ⅰ是Al(OH)3;
(3)沉淀Ⅱ是Fe(OH)3;
(4)沉淀Ⅰ是Al(OH)3,证明沉淀Ⅰ已洗涤干净的实验操作是检验洗涤液中师傅汉语硫酸根离子设计实验检验;
(5)从滤液中得到K2SO4晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到晶体;
(6)电解时阳极发生反应生成FeO42-,依据化合价的变化和电荷守恒书写电极反应.
(2)分析流程结合氧化铝的性质可知,沉淀Ⅰ是Al(OH)3;
(3)沉淀Ⅱ是Fe(OH)3;
(4)沉淀Ⅰ是Al(OH)3,证明沉淀Ⅰ已洗涤干净的实验操作是检验洗涤液中师傅汉语硫酸根离子设计实验检验;
(5)从滤液中得到K2SO4晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到晶体;
(6)电解时阳极发生反应生成FeO42-,依据化合价的变化和电荷守恒书写电极反应.
解答:
解:利用明矾石(主要成分是K2SO4?Al2(SO4)3?2Al2O3?6H2O,此外还含有少量Fe2O3杂质)制备Al2O3、K2FeO4和H2SO4的工艺流程:明矾脱水后主要成分是K2SO4?Al2(SO4)3?2Al2O3,“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S
Al2O3+9SO2,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,灼烧生成Al2O3,母液中离子主要有K+、SO42-,含有溶质为K2SO4,滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,通入氯气:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O,制得K2FeO4;
(1)“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S
Al2O3+9SO2,反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,生成102gAl2O3的物质的量为n=
=
=1mol,需要硫的物质的量为1mol×
=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为N=nNA=6mol×NAmol-1=6NA,
故答案为:2Al2(SO4)3+3S
Al2O3+9SO2;6NA;
(2)分析流程结合氧化铝的性质可知,铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,沉淀Ⅰ是Al(OH)3,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(3)滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,沉淀Ⅱ是Fe(OH)3;
故答案为:Fe(OH)3;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净;
故答案为:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净;
(5)从滤液中得到K2SO4晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到晶体,故答案为:蒸发结晶;
(6)阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-;电极反应为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O.
| ||
(1)“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S
| ||
| m |
| M |
| 102g |
| 102g/mol |
| 3 |
| 2 |
故答案为:2Al2(SO4)3+3S
| ||
(2)分析流程结合氧化铝的性质可知,铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,沉淀Ⅰ是Al(OH)3,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓;
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(3)滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,沉淀Ⅱ是Fe(OH)3;
故答案为:Fe(OH)3;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净;
故答案为:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已将沉淀洗干净;
(5)从滤液中得到K2SO4晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到晶体,故答案为:蒸发结晶;
(6)阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-;电极反应为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评:本题以铝、铁的化合物为载体考查了物质间的反应、物质的分离和电解等知识点,明确物质之间的反应是解本题关键,这种综合性较强的题型是高考热点,须利用基础知识细心分析解答,题目难度中等.

练习册系列答案
相关题目
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A、稀硝酸 | B、稀盐酸 |
| C、硝酸铜 | D、氢氧化钠 |
下列化学工业有关设备、原料、反应条件配套的是( )
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
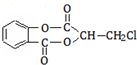 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去).
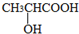 )经过几步有机反应制得,其中最佳的次序是:
)经过几步有机反应制得,其中最佳的次序是:
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.