题目内容
8. 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.实验室合成乙酸乙酯的步骤如下:
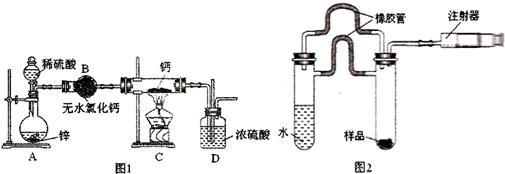
(一)制备乙酸乙酯粗产品:如图所示的仪器装置,在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,得到含有乙醇、醋酸和水的乙酸乙酯粗产品.
(1)写出蒸馏烧瓶中发生的化学方程式:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)冷凝水流经冷凝管时应从b进入(填“a”或“b”).
(3)烧瓶中加入碎瓷片的目的是防止暴沸.
(二)对乙酸乙酯进行精制
(1)为了除去粗产品其中的醋酸,可向产品中加入饱和碳酸钠溶液,然后进行分液(填操作)
(2)再向得到的有机物中加入饱和氯化钙溶液,振荡、分离,除去乙醇.
(3)最后,加入无水硫酸钠除去其中的水分,再进行蒸馏(填操作),即可得到纯净的乙酸乙酯.
分析 (一)在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后滴加醋酸,加热条件下发生酯化反应生成乙酸乙酯,蒸馏可得到乙酸乙酯的粗产品,实验时注意防止液体暴沸;
(二)乙酸乙酯不溶于饱和碳酸钠溶液,乙酸可与碳酸钠溶液反应,试管Ⅱ中盛有饱和碳酸钠溶液,分液,用氯化钙除去乙醇,蒸馏可得到乙酸乙酯.
解答 解:(一)(1)蒸馏烧瓶中发生反应的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)为充分冷凝,使蒸馏水充满冷凝管,则应从下端,即b进冷凝水,故答案为:b;
(3)纯液体在加热时易暴沸,应加入碎瓷片,故答案为:防止暴沸;
(二)(1)醋酸可与饱和碳酸钠溶液反应而除去,且乙酸乙酯不溶于饱和碳酸钠溶液,可分液分离,故答案为:饱和碳酸钠溶液;分液;
(3)乙酸乙酯中混有乙醇,乙醇可与氯化钙反应而被吸收,然后用蒸馏的方法可得到纯净的乙酸乙酯,故答案为:蒸馏;.
点评 本题考查有机物的制备实验,为高频考点,侧重分析与实验能力的考查,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,注意混合物的加入顺序,题目难度不大.

练习册系列答案
相关题目
13.下列离子方程式中不正确的是( )
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入盐酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入过量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
10.有关Al与NaOH溶液反应的说法中正确的是( )
| A. | 铝是还原剂,其氧化产物是H2 | B. | NaOH是氧化剂,其还原产物是H2 | ||
| C. | 铝是还原剂,H2O和NaOH都是氧化剂 | D. | H2O是氧化剂,Al被氧化 |
3.已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
下列说法中,不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系 能量的变化 | ||||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ | |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 平衡时,两容器中CO2的浓度相等 | |
| C. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| D. | 容器①中CO反应速率等于H2O(g)的反应速率 |
18.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(5)己知:
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
 醋酸亚铬水合物
醋酸亚铬水合物