题目内容
12.将NO2、CO2的混合气体通过装有足量Na2O2的容器后,再用干燥烧瓶收集得到混合气体2.5mol,然后倒立于水槽中,最后水充满整个烧瓶(已知:4NO2+O2+2H2O=4HNO3),则混合气体中NO2的物质的量是2mol.分析 将NO2、CO2的混合气体通过装有足量Na2O2的容器后,再用干燥烧瓶收集得到混合气体2.5mol,烧瓶中混合气体为二氧化氮和氧气,然后倒立于水槽中,最后水充满整个烧瓶,说明二氧化氮和氧气的物质的量之比为4:1,据此计算二氧化氮物质的量.
解答 解:将NO2、CO2的混合气体通过装有足量Na2O2的容器后,再用干燥烧瓶收集得到混合气体2.5mol,烧瓶中混合气体为二氧化氮和氧气,然后倒立于水槽中,最后水充满整个烧瓶,说明二氧化氮和氧气的物质的量之比为4:1,则二氧化氮物质的量=2.5mol×$\frac{4}{5}$=2mol,
故答案为:2mol.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算及理解题干信息能力,明确二氧化氮和氧气与水反应时二者关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
2.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
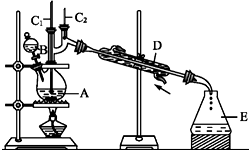
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%.

发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%.
3. 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C (s) 的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BC
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
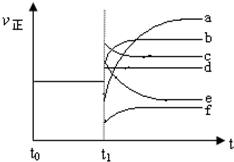
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号.
①缩小容器体积b;
②降低温度f.
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C (s) 的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BC
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号.
①缩小容器体积b;
②降低温度f.
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60① | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正_②>ν逆 |
20.0.3mol的气体高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态H2O,放出649.5kJ的热量.又知:H2O(l)═H2O(g)△H=+44kJ/mol.下列热化学方程式正确的是( )
| A. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165kJ•mol-1 | |
| B. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ•mol-1 | |
| C. | B2H6(g)+3O2(g)═B2O3+3H2O△H=-2165kJ•mol-1 | |
| D. | B2H6(g)+O2(g)═B2O3(s)+H2O(l)△H=-2165kJ•mol-1 |
17.下列除去杂质(括号内的物质为杂质)的方法中错误的是( )
| A. | FeSO4(CuSO4):加足量铁粉后,过滤 | |
| B. | CO(CO2):用NaOH溶液洗气后干燥 | |
| C. | MnO2(KCl):加水溶解后,过滤、洗涤、烘干 | |
| D. | N2(O2):通过灼热的氧化铜 |
4.下列各组中两种溶液间的反应,均可用同一离子方程式表示的是( )
| A. | HCl+Na2CO3、HCl+NaHCO3 | B. | BaCl2+Na2SO4、Ba(OH)2+NaHSO4 | ||
| C. | KOH+HCl、Ba(OH)2+H2SO4 | D. | 石灰石与硝酸、石灰石与盐酸 |
1.下列药品中主要成分不属于天然药物的是( )
| A. | 麻黄碱 | B. | 青霉素 | C. | 板蓝根冲剂 | D. | 牛黄解毒丸 |
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.