题目内容
13.下列离子方程式中不正确的是( )| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入盐酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入过量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.二者反应生成氯化钙、二氧化碳和水;
B.二者反应生成氯化钙和水;
C.二者反应生成硫酸钡和水;
D.不符合反应客观事实.
解答 解:A.盐酸滴在石灰石上,离子方程式:CaCO3+2H+═Ca2++H2O+CO2↑,故A正确;
B.向澄清石灰水中加入盐酸溶液,离子方程式:H++OH-═H2O,故B正确;
C.向Ba(OH)2溶液中滴入过量的Na2SO 溶液,离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D.稀硫酸滴在铜片,二者不发生反应,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确离子反应实质及书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.

练习册系列答案
相关题目
3. 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C (s) 的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BC
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
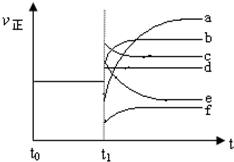
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号.
①缩小容器体积b;
②降低温度f.
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(增大、减小、不变).
(2)上述反应达到平衡后,增加H2O(g)的量,则C (s) 的物质的量减小(增大、减小、不变).
(3)下列说法一定能判断如上反应达平衡的是BC
A.消耗1mol H2O(g)同时生成1mol H2
B.容器内混合气体的总质量不变
C.恒温恒容时容器内气体的压强不变
D.H2O(g)、CO (g)、H2 (g)三种气体的浓度比为1:1:1
(4)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号.
①缩小容器体积b;
②降低温度f.
(5)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中①②相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60① | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正_②>ν逆 |
4.下列各组中两种溶液间的反应,均可用同一离子方程式表示的是( )
| A. | HCl+Na2CO3、HCl+NaHCO3 | B. | BaCl2+Na2SO4、Ba(OH)2+NaHSO4 | ||
| C. | KOH+HCl、Ba(OH)2+H2SO4 | D. | 石灰石与硝酸、石灰石与盐酸 |
1.下列药品中主要成分不属于天然药物的是( )
| A. | 麻黄碱 | B. | 青霉素 | C. | 板蓝根冲剂 | D. | 牛黄解毒丸 |
18.下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A. | 硫酸、Na2CO3•10H2O、Ca(OH)2 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、生石灰 | D. | 硝酸、食盐水、烧碱 |
5.下列离子方程式正确的是( )
| A. | NaOH溶液中滴入CuSO4溶液 OH-+Cu2+=Cu(OH)2↓ | |
| B. | 乙醛发生银镜反应CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4+2Ag↓+3NH3+H2O | |
| C. | 醋酸与碳酸钠溶液反应 CO32-+2H+=H2O+CO2↑ | |
| D. | 溴乙烷中滴入AgNO3溶液 Ag++Br-=AgBr↓ |
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH. NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题: