题目内容
3.为了测定某有机物A的结构,做如下实验:①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
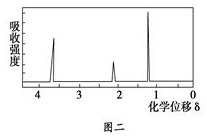
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1:2:3.试回答下列问题:
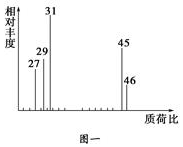
(1)有机物A的相对分子质量是46.
(2)有机物A的实验式是C2H6O.
(3)A的分子式是C2H6O.
(4)A的结构简式为CH3CH2OH.
(5)与A互为同分异构体的B为CH3OCH3;如何鉴别A与B分别取少量两物质于试管中,加入适量金属钠,产生气泡的为CH3CH2OH,不产生气泡的为CH3OCH3.
分析 (1)在A的质谱图中,最大质荷比为46,据此可确定其相对分子质量;
(2)将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水,根据质量守恒定律确定其最简式;
(3)A的相对分子质量为46,根据(2)的实验式确定其分子式;
(4)由A的核磁共振氢谱知A中有3种氢原子,个数比为1:2:3,据此确定A的结构简式;
(5)A为CH3CH2OH,与A互为同分异构体的为甲醚;甲醚不与钠反应,而乙醇反应,据此可鉴别A、B.
解答 解:(1)在A的质谱图中,最大质荷比为46,所以A的相对分子质量为46,
故答案为:46;
(2)将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水,根据蒸馏水可知:n(C)=n(CO2)=0.1mol,m(C)=0.1 mol×12 g•mol-1=1.2 g,
n(H)=$\frac{2.7g}{18g/mol}$×2=0.3 mol,m(H)=0.3 mol×1 g•mol-1=0.3 g,该有机物分子中含有C、H元素的总质量为:1.2g+0.3g=1.5g,说明其分子中一定含有氧元素,含有氧元素质量为:m(O)=2.3 g-1.2 g-0.3 g=0.8 g,则n(O)=$\frac{0.8g}{16g/mol}$=0.05 mol,
所以n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,A的实验式是C2H6O,
故答案为:C2H6O;
(3)该有机物的实验式C2H6O,其相对分子质量是46,故其实验式即为分子式,
故答案为:C2H6O;
(4)由A的核磁共振氢谱知A中有3种氢原子,个数比为1:2:3,所以A的结构简式为:CH3CH2OH,
故答案为:CH3CH2OH;
(5)A为CH3CH2OH,与A互为同分异构体的为甲醚,其结构简式为:CH3OCH3;
甲醚不与钠反应,而乙醇反应,则鉴别乙醇和甲醚的方法为:分别取少量两物质于试管中,加入适量金属钠,产生气泡的为CH3CH2OH,不产生气泡的为CH3OCH3,
故答案为:CH3OCH3;分别取少量两物质于试管中,加入适量金属钠,产生气泡的为CH3CH2OH,不产生气泡的为CH3OCH3.
点评 本题考查了分子式、结构简式确定的计算,题目难度不大,明确常见有机物组成、结构与性质为解答关键,注意掌握守恒思想在确定有机物分子式中的应用,试题培养了学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 容量瓶用蒸馏水洗涤后未干燥即用来配制溶液 | |
| B. | 定容时,观察液面俯视刻度线 | |
| C. | 摇匀后,液面低于刻度线,没有再加蒸馏水 | |
| D. | 用蒸馏水洗涤烧杯和玻璃棒.并将洗涤液转移入容量瓶中 |
| A. | “物质的量”是衡量物质重量的物理量 | |
| B. | 氢氧化钠的摩尔质量是40g | |
| C. | 物质的量浓度的常用单位是mol•L-1 | |
| D. | 1mol任何物质所占有的体积都是22.4L |
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、熔融状态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |
| A. | 向NaHCO3溶液中滴加澄清石灰水,不会产生沉淀 | |
| B. | 等质量NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2在同温同压下体积相同 | |
| C. | 向Na2CO3溶液中缓慢通入等物质的量的HCl,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 向Na2CO3饱和溶液中通入CO2,有晶体析出 |
| A. | 铝片与稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 氢氧化钠与稀盐酸反应 | D. | 甲烷在氧气中燃烧 |
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |