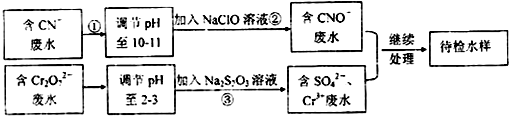
题目内容
9.下列相应叙述正确的是( )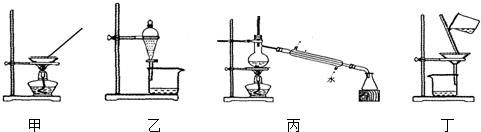
| A. | 可用甲装置蒸发氯化铵溶液制氯化铵 | |
| B. | 可用乙装置加水分离碘酒中的碘 | |
| C. | 可用丙装置分离乙醇和水 | |
| D. | 可用丁装置分离FeCl3溶液和Fe(OH)3胶体 |
分析 A.氯化铵加热分解;
B.碘酒不分层;
C.乙醇与水互溶,但沸点不同;
D.FeCl3溶液和Fe(OH)3胶体均可透过滤纸.
解答 解:A.氯化铵加热分解,不能蒸发氯化铵溶液制氯化铵,应选冷却结晶法,故A错误;
B.碘酒不分层,不能利用图中分液装置分离,应选蒸馏法,故B错误;
C.乙醇与水互溶,但沸点不同,则选择图中蒸馏装置可分离,故C正确;
D.FeCl3溶液和Fe(OH)3胶体均可透过滤纸,不能过滤分离,应选渗析法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
20.短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y、Z的最外层电子数与其电子层数的比值依次为l、2、3、4、2(不考虑零族元素).下列关于这些元素的叙述正确的是( )
| A. | X分别和其他四种元素均可形成至少2种化合物 | |
| B. | M、W、X、Y、Z的原子半径由大到小的顺序为Y>Z>X>W>M | |
| C. | X气态氢化物的稳定性大于Z态氢化物,但是X气态氢化物的沸点小于Z气态氢化物 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
4.下列有关海水综合利用的说法正确的是( )
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 蒸馏法淡化海水的过程中一定发生了化学变化 | |
| C. | 从海水中可以获得MgCl2,电解熔融MgCl2可制备Mg | |
| D. | 可以用分液的方法将海水淡化 |
14.具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法正确的是( )

| A. | 该物质属于芳香烃 | |
| B. | 该物质能与NaHCO3反应 | |
| C. | 该物质中存在三个苯环 | |
| D. | 一定条件下,1mol该物质最多可与2mol NaOH发生反应 |
20.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 聚氯乙烯可用作制食品包装袋的原料 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 含硫燃料燃烧产生的二氧化硫是形成酸雨的罪魁祸首 |
15.下列说法正确的是( )
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g) 不能自发进行,则该反应的△H>0 | |
| B. | 25℃时,向0.1 mol•L-1CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | Ba的金属活动性强于Mg,可以通过电解BaCl2溶液的方法获得金属钡 | |
| D. | 对硫酸工业中的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率 |
16. 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | A装置中K+移向VB2电极 | |
| D. | b装置内收集的0.448L气体(标准状况)全部为O2 |