题目内容
下列叙述正确的是( )
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、常温下,1.0×10-3 mol?L-1盐酸的pH=3.0,1.0×10-8 mol?L-1盐酸的pH=8.0 |
| D、常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A.醋酸为酸,醋酸稀释后溶液中氢离子浓度增大,溶液的pH增大;
B.酚酞的变色范围为8-10,当溶液的pH<8时,酚酞溶液变成无色;
C.盐酸为酸溶液,1.0×10-8 mol?L-1盐酸溶液的pH<7,不可能pH=8.0;
D.pH=1的盐酸的浓度为0.1mol/L,根据酸碱中和反应实质计算出氢氧根离子浓度,再计算出溶液的pH.
B.酚酞的变色范围为8-10,当溶液的pH<8时,酚酞溶液变成无色;
C.盐酸为酸溶液,1.0×10-8 mol?L-1盐酸溶液的pH<7,不可能pH=8.0;
D.pH=1的盐酸的浓度为0.1mol/L,根据酸碱中和反应实质计算出氢氧根离子浓度,再计算出溶液的pH.
解答:
解:A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液中氢离子浓度减小,溶液的pH增大,则a<b,故A错误;
B.在滴有酚酞的氨水显示红色,加入NH4Cl至溶液恰好无色时,溶液的pH<8,故B错误;
C.常温下,1.0×10-3mol?L-1盐酸的pH=3.0,而1.0×10-8 mol?L-1盐酸为酸溶液,则溶液的pH只能无限接近7,不可能为8,故C错误;
D.pH=1的盐酸的浓度为0.1mol/L,设氢氧化钠溶液浓度为c,则:0.1mol/L×0.001L=0.1c,解得:c=0.001mol/L,则氢氧化钠溶液的pH=11,故D正确;
故选D.
B.在滴有酚酞的氨水显示红色,加入NH4Cl至溶液恰好无色时,溶液的pH<8,故B错误;
C.常温下,1.0×10-3mol?L-1盐酸的pH=3.0,而1.0×10-8 mol?L-1盐酸为酸溶液,则溶液的pH只能无限接近7,不可能为8,故C错误;
D.pH=1的盐酸的浓度为0.1mol/L,设氢氧化钠溶液浓度为c,则:0.1mol/L×0.001L=0.1c,解得:c=0.001mol/L,则氢氧化钠溶液的pH=11,故D正确;
故选D.
点评:本题考查了溶液pH的计算、酸碱混合的定性判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,选项C为易错点,注意酸溶液稀释后不可能变成碱溶液,即常温下溶液的pH只能无限接近7,不可能大于7.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列事实均能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol/L醋酸溶液的pH比0.1mol/L盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢.
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol/L醋酸溶液的pH比0.1mol/L盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢.
| A、②③⑥ | B、④⑤⑥ |
| C、③④⑥ | D、①②③ |
下列各组中的两种物质作用时,反应条件改变,不会引起产物质种类变化的是( )
| A、Na和O2 |
| B、Ca(OH)2和CO2 |
| C、Fe和HCl |
| D、C和O2 |
下列说法错误的是( )
| A、自然界中金属元素比非金属元素多 |
| B、金属单质一般属于金属晶体 |
| C、导电、导热、延展性好、高熔点是金属的通性 |
| D、金属原子一般叫容易失去电子 |
在0.1mol?L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+对于该平衡,下列叙述正确的是( )
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、通入少量HCl气体,溶液中PH值增大 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
化学与社会、生活密切相关,下列说法正确的是( )
| A、纳米材料直径一般在几纳米到几十纳米(1nm=10-9m)之间,因此纳米材料属于胶体 |
| B、青铜是我国使用最早的合金 |
| C、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| D、明矾与漂白粉都是水处理药品,原理相同 |
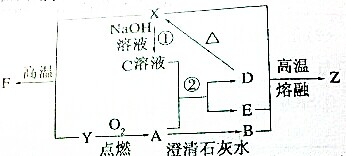 已知下列物质有如图所示转化关系,水和部分产物已略去.
已知下列物质有如图所示转化关系,水和部分产物已略去.