题目内容
下列说法错误的是( )
| A、自然界中金属元素比非金属元素多 |
| B、金属单质一般属于金属晶体 |
| C、导电、导热、延展性好、高熔点是金属的通性 |
| D、金属原子一般叫容易失去电子 |
考点:金属的通性
专题:元素及其化合物
分析:A.在元素周期表中的一百多种元素中,非金属元素有22种;
B.由金属阳离子与自由电子组成晶体为金属晶体;
C.根据金属的物理通性:金属一般具有一定的金属光泽、良好的导电性和导热性、延展性;
D.依据金属原子最外层电子数较少.
B.由金属阳离子与自由电子组成晶体为金属晶体;
C.根据金属的物理通性:金属一般具有一定的金属光泽、良好的导电性和导热性、延展性;
D.依据金属原子最外层电子数较少.
解答:
解:A.在元素周期表中的一百多种元素中,非金属元素有22种,则金属元素和种类比非金属元素多,故A正确;
B.由金属阳离子与自由电子组成晶体为金属晶体,故B正确;
C.根据金属的物理通性:金属一般具有一定的金属光泽、良好的导电性和导热性、延展性,熔点差别较大,故C错误;
D.金属原子最外层电子数较少,反应中易失去电子,故D正确;
故选:C.
B.由金属阳离子与自由电子组成晶体为金属晶体,故B正确;
C.根据金属的物理通性:金属一般具有一定的金属光泽、良好的导电性和导热性、延展性,熔点差别较大,故C错误;
D.金属原子最外层电子数较少,反应中易失去电子,故D正确;
故选:C.
点评:本题考查了金属的结构和通性,熟悉金属晶体的结构是解题关键,题目难度不大.

练习册系列答案
相关题目
下列过程中的焓变小于零的是( )
| A、石灰石高温分解 |
| B、氢氧化钡晶体与氯化铵晶体反应 |
| C、二氧化碳与碳反应 |
| D、铝与盐酸反应 |
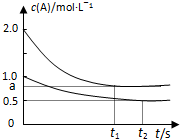 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( ) | 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)<v(逆) |
在pH都等于9的KOH和CH3COOK两种溶液中,设由水电离产生的OH-离子浓度分别为Xmol/L与Ymol/L,则X和Y的关系为( )
| A、X=Y |
| B、Y=10-4 X |
| C、X=10-4 Y |
| D、X>Y |
下列叙述正确的是( )
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、常温下,1.0×10-3 mol?L-1盐酸的pH=3.0,1.0×10-8 mol?L-1盐酸的pH=8.0 |
| D、常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
下列措施或事实不是因平衡移动引起的是( )
| A、新制的氯水在光照下颜色变浅 |
| B、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| C、H2、I2、HI平衡混合气加压后颜色变深 |
| D、在合成氨的反应中,加压有利于氨的合成 |
下列工业生产的主要化学反应,不牵涉勒沙特列原理的是( )
| A、合成氨工业 | B、硫酸工业 |
| C、氯碱工业 | D、纯碱工业 |
下列哪一项是通过降低反应所需的能量和增加活化分子的百分数来加快反应速率的( )
| A、增大物质的量浓度 |
| B、增大压强 |
| C、升高温度 |
| D、使用催化剂 |
下列叙述正确的是( )
| A、1 mol H2O的质量为18g/mol |
| B、-20℃,18g H2O中含有2mol H和1mol O |
| C、将2mol NaOH 溶于1L水中配成溶液的浓度为2mol?L-1 |
| D、3.01×1023个SO2分子的质量为64g |