题目内容
6.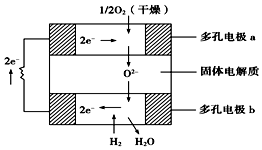 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | b极的电极反应式为H2+O2--2e-═H2O | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 氧化锆的作用是让电子在电池内部通过 |
分析 该电池属于固体燃料电池,以固体氧化锆-氧化钇为电解质,电池工作时,正极上氧气得电子生成阳离子,则正极上反应为O2+4e-=2O2-;负极为氢气失电子发生氧化反应,负极:2H2-4e-+2O2-═2H2O,总反应为:2H2+O2=2H2O.
解答 解:A、在燃料电池中,有O2参加的a极为原电池的正极,故A错误;
B、b极是负极,氢气失电子的氧化反应,该电极的电极反应式为H2+O2--2e-═H2O,故B正确;
C、a极为正极,电极反应为:O2+4e-=2O2-,故C错误;
D、氧化锆的作用是让离子在电池内部通过,电子不能进入电解质,故D错误.
故选B.
点评 本题考查原电池的工作原理,涉及正负极的判断,电极反应式的书写等问题,题目难度不大,注意基础知识的积累.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
17.对已经达到化学平衡的下列反应2NO(g)+O2(g)?2NO2(g)减小压强时,对反应产生的影响是( )
| A. | 正、逆反应速率都减小 | B. | 正、逆反应速率都增大 | ||
| C. | 逆反应速率增大,正反应速率减小 | D. | 逆反应速率减小,正反应速率增大 |
1.短周期元素中,族序数等于周期数的两倍的元素是( )
| A. | N | B. | O | C. | S | D. | Si |
15.下列意外事故的处理方法中,错误的是( )
| A. | 皮肤烫伤后刺痛发红,应立即用凉水冲洗、浸泡 | |
| B. | 温度计打破,其中的水银流出,立即把看得见的水银收集并放入瓶中密闭,在洒落水银的地方撒上硫黄粉 | |
| C. | 在胶塞上安装玻璃管时,不小心手被玻璃管割伤,先除去伤口处的玻璃,再用75%的酒精擦洗水消毒,之后找医生敷药包扎 | |
| D. | 不小心将酒精灯碰倒在桌面上,燃烧起来,立即用手拍打把火扑灭 |
14.下列叙述正确的是( )
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 胶体微粒不能透过滤纸 | |
| C. | 向沸水中加入Fe(OH)3可制得Fe(OH)3胶体 | |
| D. | 利用丁达尔效应可以区别溶液与胶体 |
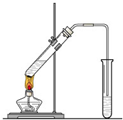 在实验室我们也可以用右图所示的装置制取乙酸乙酯.
在实验室我们也可以用右图所示的装置制取乙酸乙酯.
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;