题目内容
18.分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
(1)以下叙述中,正确的是CD.
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式是:甲为化学能转化为热能;乙为化学能转化为电能.
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯,在锌片上就形成原电池.
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应方程式:
铜电极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Cu+Zn2+.
当电路中转移0.25mol电子时,消耗负极材料的质量为8.125g.
分析 (1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;形成原电池加快反应速率,并且电流方向为正极到负极,离子移动阴离子移向阴极,据此分析判断;
(2)原电池是将化学能转变为电能,化学反应是将化学能转化为热能;
(3)原电池正极上氢离子放电生成氢气,则锌片有气泡产生说明锌片不纯,据此分析;
(4)如果电解质溶液是硫酸铜溶液,铜电极上铜离子得电子发生还原反应,总反应为锌置换出铜的反应,根据负极锌失电子计算消耗负极材料的质量.
解答 解:(1)A.甲不能构成原电池,只有锌和稀硫酸发生氧化还原反应,乙池中能构成原电池,锌作负极,铜作正极,故A错误;
B.甲池中不能构成原电池,所以甲池中铜电极上没有气泡产生,故B错误;
C.两烧杯中都是氢离子得电子生成氢气,锌失电子发生氧化反应,所以溶液的pH均增大,故C正确;
D.能形成原电池的加快反应速率,所以产生气泡的速度甲中比乙中慢,故D正确;
E.乙的外电路中电流方向Cu→Zn,故E错误;
F.乙溶液中SO42-向负极Zn片方向移动,故F错误;
故选CD;
(2)甲中不能形成原电池,所以是将化学能转变为热能,乙池能构成原电池,所以是将化学能转化为电能,故答案为:化学能转化为热能;化学能转化为电能;
(3)锌片有气泡产生说明锌片不纯,锌和锌片中的杂质构成原电池,杂质作正极,氢离子在杂质上得电子生成氢气,故答案为:锌片不纯,在锌片上就形成原电池;
(4)如果将稀硫酸换成硫酸铜溶液,则正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,总反应为锌置换出铜的反应即Zn+Cu2+=Cu+Zn2+,负极锌失电子所以当电路中转移0.25mol电子时,消耗负极材料的质量为$\frac{0.25}{2}$×65=8.125g,
故答案为:Cu2++2e-=Cu;Zn+Cu2+=Cu+Zn2+;8.125g.
点评 本题考查原电池的组成和工作原理,题目难度中等,注意把握电极方程的书写方法,注意基础知识的积累.

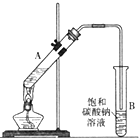 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
C2H5OH+C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$\stackrel{△}{→}$CH3COOCH2CH3+H2O.
| A. | 镁的金属活动性比铷强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性比RbCl弱 | |
| D. | Rb单质比RbCl更稳定 |
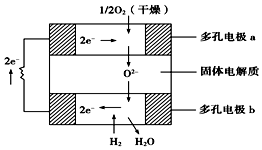 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | b极的电极反应式为H2+O2--2e-═H2O | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 氧化锆的作用是让电子在电池内部通过 |
①NO(g)+Br2(g)?NOBr2(g) 快
②NO(g)+NOBr2(g)?2NOBr(g) 慢
下列有关该反应的说法正确的是( )
| A. | 该反应的速率主要取决于①的快慢 | |
| B. | NOBr2是该反应的催化剂 | |
| C. | 正反应的活化能比逆反应的活化能小a kJ•mol-1 | |
| D. | 增大Br2(g)浓度能增大活化分子百分数,加快反应速率 |
| A. | 聚丙烯的结构简式为: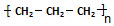 | B. | 四氯化碳分子的电子式: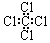 | ||
| C. | 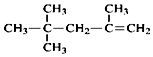 的名称为:2,4,4-三甲基-1-戊烯 的名称为:2,4,4-三甲基-1-戊烯 | D. | 乙醇分子比例模型: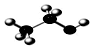 |
| A. | 卫生纸 | B. | 电池 | C. | 纯棉纺织品 | D. | 农用塑料薄膜 |
| A. | 实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 | |
| B. | SO3溶于水能导电,所以它是电解质 | |
| C. | 胶体中分散质微粒能透过滤纸不能透过半透膜 | |
| D. | 不与酸反应的氧化物一定会跟碱反应 |
| A. | Na、Al、S2- | B. | Fe3+、MnO4-、NO3- | C. | Cl2、HClO、Mg | D. | O2、Cl-、Na+ |