题目内容
14.如图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是( )
| A. | X为氧气 | |
| B. | 电极A反应式:CH3CH2OH-12e-+3H2O═2CO2+12H+ | |
| C. | 电极材料活泼性:A>B | |
| D. | B电极附近溶液pH增大 |
分析 该燃料电池中,根据电子流向知,A是负极、B是正极,燃料电池中加入燃料的电极是负极、通入氧化剂的电极是正极,所以X是乙醇、Y是氧气,电解质溶液呈碱性,负极电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,正极反应式为O2+4e-+2H2O=4OH-,据此分析解答.
解答 解:该燃料电池中,根据电子流向知,A是负极、B是正极,燃料电池中加入燃料的电极是负极、通入氧化剂的电极是正极,所以X是乙醇、Y是氧气,电解质溶液呈碱性,负极电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,正极反应式为O2+4e-+2H2O=4OH-,
A.通过以上分析知,X是乙醇,Y是氧气,故A错误;
B.负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,故B错误;
C.在燃料点池中,电极的活泼性可以没有差距,只要能导电即可,如都用石墨作电极,故C错误;
D.负极电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,正极反应式为O2+4e-+2H2O=4OH-,
负极消耗氢氧根离子、正极生成氢氧根离子,所以正极附近溶液的pH增大,即B电极附近溶液pH增大,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,正确判断正负极是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度不大.

练习册系列答案
相关题目
5.常温下,一定量冰醋酸加水稀释过程中,溶液的导电性如下图所示.下列说法正确的是( )
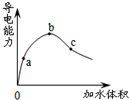

| A. | pH值:b>a>c | |
| B. | 与锌反应起始速率:a=b=c | |
| C. | 水电离的c(H+) c>a>b | |
| D. | 加入足量的NaHCO3固体,产生气体体积:a>b>c |
2.下列用来表示物质变化的化学用语中,错误的是( )
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 用Pt电极电解氯化铝溶液:2Cl-+2 H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2+2OH- | |
| D. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O |
9.有一种新合成的烃称为立方烷,它的碳架结构如图所示,关于它的说法不正确的是( )


| A. | 它的分子式是C8H8 | B. | 与苯乙烯 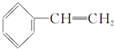 互为同分异构体 互为同分异构体 | ||
| C. | 它不能发生加成反应 | D. | 它的二氯取代物共有4种 |
19.下列说法正确的是( )
| A. | 1gH2和4gO2反应放出71.45kJ热量,则氢气的燃烧热为142.9 kJ•mol-1 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(1)△H=-57.3 kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量大于57.3kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
4.(1)常温下,用 0.1000mol•L-1NaOH溶液滴定 20.00mL 0.1000mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5
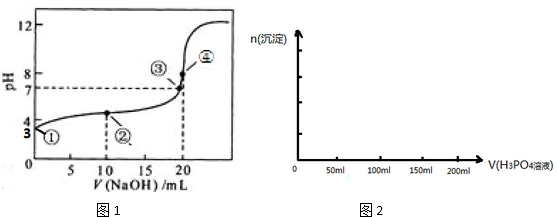
(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
0.01mol•L-1 Na2SO3溶液中通入SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.