题目内容
12.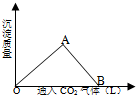 (1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.试回答:
AB段曲线所表示的反应化学方程式是:CaCO3+CO2+H2O═Ca(HCO3)2.
将B处生成的溶液煮沸,反应化学方程式是:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O.
(2)已知硫可与热的KOH溶液发生反应,反应方程式如下:3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O
据此回答以下问题:
①在上述反应中,氧化剂与还原剂的物质的量之比为2:1.
②在上述反应中,若有3mol硫单质参与反应,则转移电子的物质的量是4mol.
分析 (1)AB段曲线是碳酸钙与二氧化碳、水反应转化为碳酸氢钙,B处最终为Ca(HCO3)2溶液,煮沸蒸干中Ca(HCO3)2分解为碳酸钙、二氧化碳与水;
(2)①反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3;
②根据参加反应的S计算生成K2SO3的物质的量,再结合S元素化合价变化计算转移电子.
解答 解:(1)AB段曲线是碳酸钙与二氧化碳、水反应转化为碳酸氢钙,反应方程式为:CaCO3+CO2+H2O═Ca(HCO3)2,
B处最终为Ca(HCO3)2溶液,煮沸蒸干中Ca(HCO3)2分解为碳酸钙、二氧化碳与水,反应方程式为:Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O,
故答案为:CaCO3+CO2+H2O═Ca(HCO3)2;Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O;
(2)①反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3,由还原产物、氧化产物的化学计量数,可知反应中氧化剂与还原剂的物质的量之比为2:1,
故答案为:2:1;
②由方程式可知生成K2SO3的物质的量为3mol×$\frac{1}{3}$=1mol,转移电子为1mol×(4-0)=4mol,
故答案为:4.
点评 本题考查氧化还原反应概念与计算、元素化合物性质,难度不大,根据化合价判断氧化剂与还原剂、还原产物与氧化产物是关键,判断后也可根据电子转移守恒计算氧化剂与还原剂的物质的量之比.

练习册系列答案
相关题目
2.下列用来表示物质变化的化学用语中,错误的是( )
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 用Pt电极电解氯化铝溶液:2Cl-+2 H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2+2OH- | |
| D. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O |
20.某有机物有如下性质:①能和银氨溶液共热得到银镜;②加入碳酸氢钠无变化;③与含酚酞的氢氧化钠溶液共热,发现红色褪去.则该有机物可能是( )
| A. | 乙酸 | B. | 乙醛 | C. | 甲酸乙酯 | D. | 乙醇 |
4.(1)常温下,用 0.1000mol•L-1NaOH溶液滴定 20.00mL 0.1000mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5
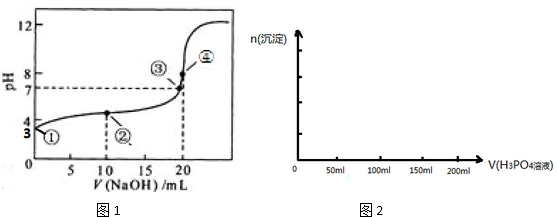
(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
0.01mol•L-1 Na2SO3溶液中通入SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.
17.用来证明淀粉部分水解的试剂是( )
①碘水 ②KI溶液 ③银氨溶液 ④FeCl3溶液.
①碘水 ②KI溶液 ③银氨溶液 ④FeCl3溶液.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C