题目内容
10.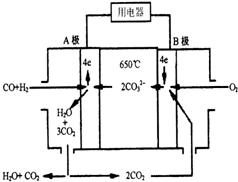 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.请回答下列问题:
(1)A极为负极,发生氧化(填“氧化”或“还原”)反应.
(2)B极的电极反应式为O2+2CO2+4e-=2CO32-;
(3)电池总反应式为CO+H2+O2=CO2+H2O.
分析 该碳酸盐燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,正极上氧气得电子结合二氧化碳生成碳酸根离子,根据负极、正极的电极方程式来书写总反应方程式.
解答 解:(1)该燃料电池中,负极的气体按物质的量之比为1:1参与反应,A极通入燃料,则A极为负极;负极上一氧化碳、氢气失电子发生氧化反应,
故答案为:负;氧化;CO+H2-4e-+2CO32-=3CO2+H2O;
(2)B极为正极,正极上氧气得电子结合二氧化碳生成碳酸根离子,正极的电极反应式为:O2+2CO2+4e-=2CO32-;
故答案为:O2+2CO2+4e-=2CO32-;
(3)负极电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极电极反应为O2+2CO2+4e-=2CO32-,则电池总反应方程式为:CO+H2+O2=CO2+H2O;
故答案为:CO+H2+O2=CO2+H2O.
点评 本题考查燃料电池的有关知识点,题目难度中等,注意把握燃烧电池中正负极的判断以及电极方程式的书写方法,注意电解质对电极方程式的影响.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
20.下列减小环境污染的方法,其原理不涉及化学变化的是( )
| A | B | C | D | |
| 污染 | 废旧热固性塑料 | 煤燃烧 | 含Hg2+的工业废水 | 生活垃圾 |
| 方法 | 粉碎作为填充剂 | 煤中加入适量石灰石 | 加入Na2S溶液 | 焚烧发电 |
| A. | A | B. | B | C. | C | D. | D |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
5.常温下,下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) | |
| B. | 向0.1 mol•L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.3 mol•L-1的 HY溶液与0.3 mol•L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1 |
15.足量的铁粉和热的稀HNO3反应,反应后溶液中只有Fe(NO3)2,并放出N2O气体2.24L(标准状况下),则反应中被氧化的铁粉质量是( )
| A. | 11.2g | B. | 22.4g | C. | 5.6g | D. | 56g |
2.下列分子式表示物质种类最多的是( )
| A. | C4H8 | B. | C5H12O | C. | C5H11Br | D. | 酯C5H10O2 |
9.下表是3种物质在水中的溶解度(20℃),下列说法中正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 54.6 | 0.000 84 | 0.039 |
| A. | 已知MgCO3的Ksp=2.14×10-5 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=2.14×10-5mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将适量的表中的三种物质分别与足量水混合,充分加热、灼烧,最终的固体产物相同 | |
| D. | 用石灰水处理水中的Mg2+和HCO3-,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
 .
.
 ;
; .
.