题目内容
4.已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )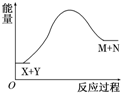
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
分析 A.由图可知,生成物的总能量大于反应物的总能量,而不是某一种反应物或生成物的能量关系;
B.吸热反应不一定在加热的条件下发生;
C.该反应为吸热反应,△H=破坏反应物中的化学键所吸收的能量-形成生成物中化学键所放出的能量>0;
D.加入催化剂,正、逆化学反应速率同等程度的增大.
解答 解:A.由图可知,M和N的总能量大于X和Y的总能量,不能说明X的能量一定低于M的能量,Y的能量一定低于N的能量,故A错误;
B.吸热反应不一定在加热的条件下发生,比如氯化铵和十水合氢氧化钡的反应就是吸热反应,但是不需加热条件就能发生,故B错误;
C.由图可知,生成物的总能量大于反应物的总能量,该反应为吸热反应,所以破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故C正确;
D.加入催化剂,正、逆化学反应速率同等程度的增大,因此加入催化剂可增大正反应速率和逆反应速率,故D错误;
故选C.
点评 本题考查吸热反应与放热反应,可以根据能量守恒从反应物与生成物的总能量、化学键的断裂与形成两个角度进行理解,难度不大.

练习册系列答案
相关题目
14.0.01mol•L-1H B溶液的pH=2,将溶液稀释100倍后,溶液的pH值可能为( )
| A. | 1 | B. | 4 | C. | 5 | D. | 8 |
15.下列各原子或离子的电子排布式错误的是( )
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
19.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为4H2+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)下列叙述能说明此反应达到平衡状态的是bce.
a.单位时间内生成n mol CH3OH的同时生成n mol H2O
b.CO2和H2的物质的量分数保持不变
c.CO2和H2的浓度保持不变
d.混合气体的密度保持不变
e.生成1mol CO2生成的同时有3mol H-H键断裂
(2)该反应过程中部分数据见下表:
①20min时,反应是否达到平衡状态?是(填“是”或“否”).
简述理由:20min时,n(CH3OH)为1mol,与30min时相同.
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1;
平衡时c(H2)=1.5mol/L;平衡时CO2的转化率为50%.
③在其它条件不变下,若20min时向该密闭容器中通入1mol H2,此时该反应速率将增大(填“增大”或“减小”).
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为4H2+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)下列叙述能说明此反应达到平衡状态的是bce.
a.单位时间内生成n mol CH3OH的同时生成n mol H2O
b.CO2和H2的物质的量分数保持不变
c.CO2和H2的浓度保持不变
d.混合气体的密度保持不变
e.生成1mol CO2生成的同时有3mol H-H键断裂
(2)该反应过程中部分数据见下表:
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
简述理由:20min时,n(CH3OH)为1mol,与30min时相同.
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1;
平衡时c(H2)=1.5mol/L;平衡时CO2的转化率为50%.
③在其它条件不变下,若20min时向该密闭容器中通入1mol H2,此时该反应速率将增大(填“增大”或“减小”).
9.硫酸亚铁煅烧反应为2FeSO4(s)$\frac{\underline{\;高温\;}}{\;}$X(g)+Fe2O3(s)+SO3(g),有关说法正确的是( )
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |
16.化学与生活密切相关,下列说法不正确的是( )
| A. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉辨别真假葡萄酒 | |
| B. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| C. | 金属的防护中,牺牲阳极的阴极保护法利用的是原电池原理 | |
| D. | 84消毒液在日常生活中广泛应用,其有效成分是Ca(ClO)2 |
14.不属于空气污染物的是( )
| A. | NO2 | B. | CO | C. | C6H6(g) | D. | CO2 |
 用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:
用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应: