题目内容
如表中列出五种短周期元素X、Y、Z、W、T的信息.
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 .
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 .
(3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 .
(4)Z2WY3溶液呈 性,其原因是(用离子方程式表示) .
(5)已知25℃、101kPa下:
①2Z(s)+
Y2(g)═Z2Y(s)△H2=-414kJ?mol-1
②2Z(s)+Y2(g)═Z2Y2(s)△H2=-511kJ?mol-1
则1mol Z2Y2(S)与足量Z(s)反应生成Z2Y(s)的热化学方程式为 .
| 元素 | 相关信息 |
| X | 基态原子最外层电子排布为nsnnpn+1 |
| Y | 其原子L层电子数是K层的3倍 |
| Z | 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
| W | 其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
| T | 其最高正价与最低负价的代数和为6 |
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有
(3)T元素的最高价氧化物对应水化物的化学式是
(4)Z2WY3溶液呈
(5)已知25℃、101kPa下:
①2Z(s)+
| 1 |
| 2 |
②2Z(s)+Y2(g)═Z2Y2(s)△H2=-511kJ?mol-1
则1mol Z2Y2(S)与足量Z(s)反应生成Z2Y(s)的热化学方程式为
考点:位置结构性质的相互关系应用,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化,元素周期律与元素周期表专题
分析:X的基态原子最外层电子排布为nsnnpn+1,n=2,X有2个电子层,最外层电子数为,5,则X为N元素;
Y原子L层电子数是K层的3倍,故Y为O元素;
Z的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,Z为Na元素;
W的单质在O2中燃烧,发出明亮的蓝紫色火焰,则w为S元素;
T的最高正价与最低负价的代数和为6,则T为Cl元素;据此进行解答.
Y原子L层电子数是K层的3倍,故Y为O元素;
Z的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,Z为Na元素;
W的单质在O2中燃烧,发出明亮的蓝紫色火焰,则w为S元素;
T的最高正价与最低负价的代数和为6,则T为Cl元素;据此进行解答.
解答:
解:根据题意可知:X的基态原子最外层电子排布为nsnnpn+1,n=2,X有2个电子层,最外层电子数为,5,则X为N元素;Y原子L层电子数是K层的3倍,故Y为O元素;Z的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,Z为Na元素;W的单质在O2中燃烧,发出明亮的蓝紫色火焰,则w为S元素;T的最高正价与最低负价的代数和为6,则T为Cl元素;
(1)Na+、O2-的核外电子排布是2、8;而S2-的核外电子排布是2、8、8.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,对于电子层结构不同的微粒来说,电子层数越多,离子半径就越大.故离子半径由小到大的顺序是Na+<O2-<S2-;17号元素Cl元素的基态原子核外电子排布式为[Ne]3s23p5;
故答案为:Na+<O2-<S2-、[Ne]3s23p5;
(2)N与Na两元素可形成化合物NaN3,其晶体中化学键类型有离子键、共价键;其晶体类型为离子晶体;故答案为:离子键、共价键;离子晶体;
(3)Cl元素的最高价氧化物对应水化物的化学式是HClO4,H2O的沸点比H2S高是因为在水的分子之间存在氢键,增加了分子之间的相互作用;
故答案为:HClO4、水分子间易形成氢键;
(4)Na2SO3是强碱弱酸盐,水解使溶液呈碱性;水解的离子方程式是SO32-+H2O?HSO3-+OH-;故答案为:碱、SO32-+H2O?HSO3-+OH-;
(5)根据盖斯定律:①×2-②,整理可得Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ/mol;故答案为:Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ/mol.
(1)Na+、O2-的核外电子排布是2、8;而S2-的核外电子排布是2、8、8.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,对于电子层结构不同的微粒来说,电子层数越多,离子半径就越大.故离子半径由小到大的顺序是Na+<O2-<S2-;17号元素Cl元素的基态原子核外电子排布式为[Ne]3s23p5;
故答案为:Na+<O2-<S2-、[Ne]3s23p5;
(2)N与Na两元素可形成化合物NaN3,其晶体中化学键类型有离子键、共价键;其晶体类型为离子晶体;故答案为:离子键、共价键;离子晶体;
(3)Cl元素的最高价氧化物对应水化物的化学式是HClO4,H2O的沸点比H2S高是因为在水的分子之间存在氢键,增加了分子之间的相互作用;
故答案为:HClO4、水分子间易形成氢键;
(4)Na2SO3是强碱弱酸盐,水解使溶液呈碱性;水解的离子方程式是SO32-+H2O?HSO3-+OH-;故答案为:碱、SO32-+H2O?HSO3-+OH-;
(5)根据盖斯定律:①×2-②,整理可得Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ/mol;故答案为:Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ/mol.
点评:本题主要考查对 构成物质的粒子--分子、原子、离子,元素周期律等考点的理解,难度不大.

练习册系列答案
相关题目
 有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:
有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:
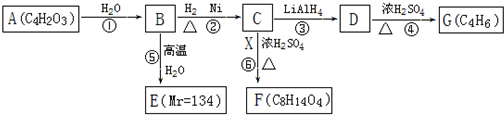
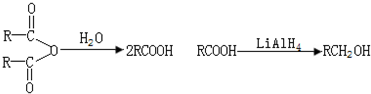
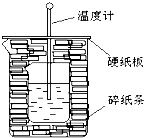 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0