题目内容
4.对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-aKJ/mol,在其他条件不变的情况下,下列说法正确的是( )| A. | 1mol CO(g)和1molH2O(g)充分反应,放出的热量为aKJ | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,速率加快,反应放出的热量不变 | |
| D. | 若将该反应设计为原电池,反应放出的热量不变 |
分析 A、该反应是可逆反应;
B、两边的计量数相等,压强的改变平衡不移动;
C、正反应是吸热反应;
D、正反应是吸热反应,不是自发的氧化还原反应.
解答 解:A、该反应是可逆反应,所以1mol CO(g)和1molH2O(g)充分反应,不可能完全转化,故A错误;
B、两边的计量数相等,压强的改变平衡不移动,所以反应放出的热量不变,故B正确;
C、正反应是吸热反应,温度升高,速率加快,平衡正向移动,反应放出的热量减少,故C错误;
D、正反应是吸热反应,不是自发的氧化还原反应,所以不能设计为原电池,故D错误;
故选B.
点评 本题考查了化学平衡移动原理分析判断,反应热量变化与平衡移动的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
12.A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素与C元素处于同一主族.下列说法正确的是( )
| A. | A元素位于元素周期表的第三周期ⅢA族 | |
| B. | B的单质只能与硫酸反应,不能与氢氧化钠溶液反应 | |
| C. | C的气态氢化物的沸点比D的气态氢化物的沸点高 | |
| D. | D的非金属性比C的非金属性强 |
12.下列叙述中正确的是( )


| A. | 图①中正极附近溶液pH减小 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②正极反应是O2+2H2O+4e-═4OH- | |
| D. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
19.下列颜色变化不属于化学变化的是( )
| A. | 向品红溶液中滴加亚硫酸 | |
| B. | KMnO4溶液滴定NaHSO3溶液,溶液由无色变为浅红色30s不褪色,即为滴定终点 | |
| C. | 久置氯水变成无色 | |
| D. | 向苯酚溶液中滴加FeCl3 |
9. 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
d.NaHCO3; pH由小到大的排列顺序是(填序号)a<d<c<b.
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,
下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-)
D.c(OH-)/c(H+) E.c(H+)•c(CH3COO-)/c(CH3COOH)
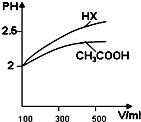
(3)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX)> Ka(CH3COOH)(填>、<或=).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中自由离子浓度的从大到小
的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
d.NaHCO3; pH由小到大的排列顺序是(填序号)a<d<c<b.
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,
下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-)
D.c(OH-)/c(H+) E.c(H+)•c(CH3COO-)/c(CH3COOH)
(3)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX)> Ka(CH3COOH)(填>、<或=).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中自由离子浓度的从大到小
的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
16.在一个固定容积的密闭容器中,可逆反应N2+3H2$?_{高温高压}^{催化剂}$2NH3达到平衡的标志是( )
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3 mol H-H发生断键反应,同时2 mol N-H发生也断键反应 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反应混合物各组分的物质的量浓度不再改变 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸. ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.