题目内容
17.某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如图所示.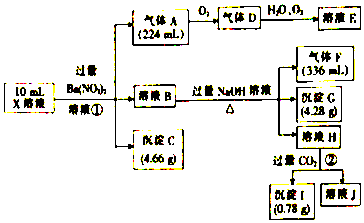
(1)通过上述实验过程,一定不存在的离子是CO32-、SO32-、NO3-.
(2)反应①中生成A的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)若测得X溶液中c(H+)=5mol/L,则X溶液中含(填“含”或“不含”)Fe3+,c(Fe3+)=1 mol/L(若填不含,则不需计算),X溶液中c(Cl-)=14.5mol/L.
分析 在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,沉淀G为Fe(OH)3,说明溶液中含有Al3+离子,计算氢氧化铁物质的量和元溶液中亚铁离子物质的量判断原溶液中含有Fe3+,溶液中含有Fe2+离子,就一定不含NO3-离子,已结溶液中电荷守恒计算确定是否含有的离子Cl-,以此解答.
解答 解:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,沉淀G为Fe(OH)3,说明溶液中含有Al3+离子,计算氢氧化铁物质的量和元溶液中亚铁离子物质的量判断原溶液中含有Fe3+,溶液中含有Fe2+离子,就一定不含NO3-离子,结合溶液中阴阳离子电荷守恒计算确定是否含有的离子Cl-,
(1)由以上分析可知一定不存在CO32-、SO32-、NO3-,故答案为:CO32-、SO32-、NO3-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)A是NO物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,F为NH3物质的量=$\frac{0.336L}{22.4L/mol}$=0.015mol,I为氢氧化铝沉淀物质的量=$\frac{0.78g}{78g/mol}$=0.01mol,10mL X溶液中n(H+)=5mol/L×0.01L=0.05mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol;,G为氢氧化铁物质的量=$\frac{4.28g}{107g/mol}$=0.04mol,原溶液中含铁离子物质的量n(Fe3+)=0.01mol,c(Fe3+)=$\frac{0.01mol}{0.01L}$=1mol/L,溶液中正电荷为:n(Fe3+)+2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=0.01×3+2×0.03mol+3×0.01mol+0.015mol+0.05mol=0.185mol;沉淀C为硫酸钡,其物质的量=$\frac{4.66g}{233g/mol}$=0.02mol,n(SO42-)=0.02mol,硫酸根离子所带的负电荷为:0.02mol×2=0.04mol,电荷守恒可知含有Cl-,n(Cl-)=0.185mol-0.04mol=0.145mol,得到溶液中氯离子浓度c(Cl-)=$\frac{0.145mol}{0.01L}$=14.5mol/L,
故答案为:含;1;14.5.
点评 本题考查无机物的推断,根据物质间发生反应的特殊现象结合离子共存来分析解答,熟悉物质的性质是解本题关键,根据溶液和硝酸钡反应生成气体确定溶液中存在亚铁离子,为解答本题的易错点,熟练掌握离子共存的条件,灵活运用知识解答,题目难度中等.

| 选项[来 | 实验 | 现象 | 结论 |
| A | 常温下,等量等表面积的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | FeCl3溶液用于刻蚀铜制印刷电路板 | 溶液变蓝 | 氧化性:Cu2+>Fe2+ |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
| A. |  操作I导致配制溶液的物质的量浓度偏小 | |
| B. |  用装置II干燥氨气 | |
| C. |  实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
(1)根据实验①对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是Ba2+、Mg2+;
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度/mol•L-1 |
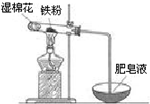 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.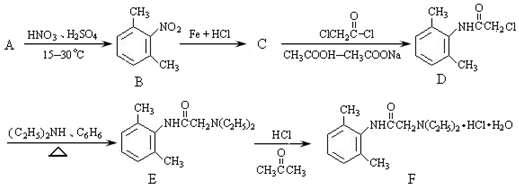
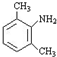 ;
;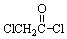 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: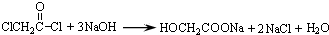 .
.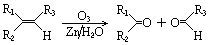
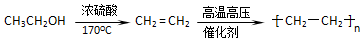

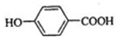 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应; (写结构简式).
(写结构简式).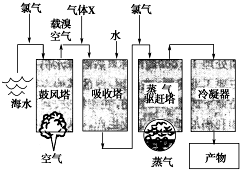 如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题: