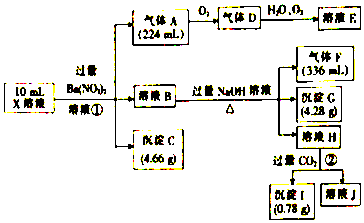
题目内容
12.下列叙述正确的是( )| A. |  操作I导致配制溶液的物质的量浓度偏小 | |
| B. |  用装置II干燥氨气 | |
| C. |  实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
分析 A.读数时眼睛应平视;
B.氨气与浓硫酸反应;
C.铁钉发生吸氧腐蚀,试管内导管液面上升;
D.滴定管读数从上到下增大.
解答 解:A.读数时眼睛应平视,如仰视,导致浓度偏大,故A错误;
B.氨气与浓硫酸反应,应用碱石灰干燥,故B错误;
C.铁钉发生吸氧腐蚀,左侧压强减小,则右侧试管内导管液面上升,故C正确;
D.滴定管读数从上到下增大,读数应为11.80mL,故D错误.
故选C.
点评 本题考查较为综合,涉及溶液的配制、气体的干燥、金属的腐蚀以及中和滴定等操作,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |
20.位于元素周期表中第二周期IVA族的元素是( )
| A. | 碳 | B. | 氧 | C. | 硅 | D. | 硫 |
7.某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | SO42-、SO32-至少含有一种 | |
| C. | 是否存在Na+需要通过焰色反应来确定 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |
4.下列各組离子在指定的溶液中一定能大量共存的是( )
| A. | 由水电离出的c (OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- | |
| B. | c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| C. | 含大量Al3+的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
6.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合后所含的分子数小于0.75NA | |
| C. | 常温下,1L PH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA | |
| D. | 在100mL 1 mol•L-5 Na2S02溶液与1.12 L(标准状况)CL2的反应中,•还原剂失电子0.2NA |
7.一种新型净水剂PAFC(聚合氯化铁铝,化学式可表示为[AlFe(OH)nCl6-n]m,n<5,m<10),广泛用于生活用水的净化和废水的净化.下列有关PAFC的说法正确的是( )
| A. | PAFC用于净化饮用水时,比用相同量的氯化铝或氯化铁对水的pH改变大 | |
| B. | PAFC中铁为+2价 | |
| C. | PAFC可看作一定比例的氯化铝和氯化铁的水解产物 | |
| D. | PAFC在强酸性或强碱性溶液中都能稳定存在 |
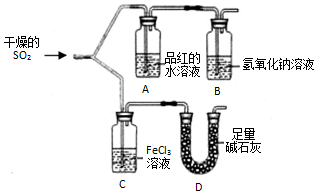 如图装置进行SO2气体性质实验.
如图装置进行SO2气体性质实验.