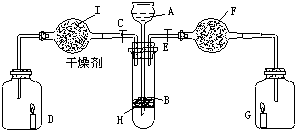
题目内容
取0.04 molKMnO4固体加热一段时间后,收集到a mol气体,在反应后的残留固体加入足量的浓盐酸,又收集到了b mol气体,设此时锰元素全部以Mn2+存在于溶液中,试计算:
(1)a+b的最小值;
(2)当a+b=0.09mol时,0.04mol KMnO4加热后所得残留的固体的质量.
(1)a+b的最小值;
(2)当a+b=0.09mol时,0.04mol KMnO4加热后所得残留的固体的质量.
考点:有关混合物反应的计算
专题:守恒思想
分析:(1)KMnO4固体,加热一段时间后,收集到甲体为氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.04×(7-2)=4a+2b,整理得a+b=0.1-a,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定(a+b)的最小值;
(2)根据a+b=0.1-a可知,生成氧气的物质的量为0.01mol,由2KMnO4
K2MnO4+MnO2+O2↑,可知生成0.01mol氧气需要高锰酸钾为0.02mol,小于0.04mol,则高锰酸钾部分分解,根据质量守恒计算残留固体的质量.
(2)根据a+b=0.1-a可知,生成氧气的物质的量为0.01mol,由2KMnO4
| ||
解答:
解:(1)KMnO4固体,加热一段时间后,收集到甲体为氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.04×(7-2)=4a+2b,整理得a+b=0.1-a,
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4
K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.04mol×
=0.02mol,即a最大值=0.02,生成氯气最少,故a+b≥0.1-0.02=0.08,故(a+b)的最小值为0.08;
答:(a+b)的最小值为0.08;
(2)根据a+b=0.1-a可知,生成氧气的物质的量为0.01mol,由2KMnO4
K2MnO4+MnO2+O2↑,可知生成0.01mol氧气需要高锰酸钾为0.02mol,小于0.04mol,则高锰酸钾部分分解,根据质量守恒,残留固体的质量为0.04mol×158g/mol-0.01mol×32g/mol=6g,
答:残留的固体的质量为6g.
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4
| ||
| 1 |
| 2 |
答:(a+b)的最小值为0.08;
(2)根据a+b=0.1-a可知,生成氧气的物质的量为0.01mol,由2KMnO4
| ||
答:残留的固体的质量为6g.
点评:本题考查混合物计算、氧化还原反应计算,难度中等,注意充分利用整个过程中的电子转移守恒解答.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
设N表示阿伏加德罗常数的值,则下述不正确的是( )
| A、1molC670H1342中含有的共价键数为2011N |
| B、12g金刚石中的碳碳单键数为2N |
| C、48g O2与O3混合气体中含氧原子个数为3N |
| D、78g过氧化钠晶体中离子总数为4N |
下列有关有机物的说法正确的是( )
| A、蛋白质、淀粉、纤维素、蔗糖都属于有机高分子化合物 |
| B、乙醇、乙酸、乙酸乙酯可以用饱和碳酸钠溶液鉴别 |
| C、乙烯和苯都可以和溴水发生化学反应 |
| D、可以用酒精萃取碘水中的碘 |