题目内容
为了证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与搁板上的固体B相遇时,即有气体产生,并发现D中的蜡烛(含C20~C30的烷烃)慢慢熄灭;关闭C打开E时,则看到G中的蜡烛燃烧得更亮,请写出该学生在装置中有关仪器的盛放的物质:A为 、B为 、F为 .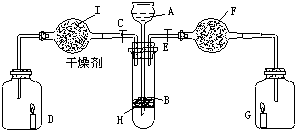
用化学方程式表示上述实验中发生的有关反应:
、 、 、 .

用化学方程式表示上述实验中发生的有关反应:
考点:性质实验方案的设计
专题:
分析:当打开活塞C,使液体A与隔板上的固体B相遇时,即有气体产生,并发现D中的蜡烛慢慢熄灭,说明该气体不支持燃烧,且密度大于空气,可能为二氧化碳;关闭C 打开E时,看到G中蜡烛燃烧得更旺,说明进入G中的气体是氧气,二氧化碳和过氧化钠反应生成氧气,则F中有过氧化钠,A和B反应时,反应物的状态是固体和液体混合且不需要加热,B为不溶性碳酸盐,一般选用CaCO3,A为HCl,通入D中的气体是CO2,结合物质的性质分析解答.
解答:
解:当打开活塞C,使液体A与隔板上的固体B相遇时,即有气体产生,并发现D中的蜡烛慢慢熄灭,说明该气体不支持燃烧,且密度大于空气,可能为二氧化碳;关闭C 打开E时,看到G中蜡烛燃烧得更旺,说明进入G中的气体是氧气,二氧化碳和过氧化钠反应生成氧气,则F中有过氧化钠,A和B反应时,反应物的状态是固体和液体混合且不需要加热,B为不溶性碳酸盐,一般选用CaCO3,A为HCl,通入D中的气体是CO2,
(1)通过以上分析知,A是HCl,B是CaCO3,F是Na2O2,
故答案为:稀盐酸;CaCO3;Na2O2;
(2)试管中盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,反应方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,
F中二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为:2Na2 O2 +2CO2 =2Na2 CO3 +O2 ,
F中水和过氧化钠反应生成氢氧化钠和氢气,反应方程式为:2Na2 O2 +2H2O=4NaOH+O2 ↑,
D和G中蜡烛燃烧生成二氧化碳和水,设蜡烛分子式为CxHy,燃烧方程式为:CxHy+(x+
)O2
xCO2+
H2O,
故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;2Na2 O2 +2CO2 =2Na2 CO3 +O2 ;2Na2 O2 +2H2O=4NaOH+O2 ↑;CxHy+(x+
)O2
xCO2+
H2O.
(1)通过以上分析知,A是HCl,B是CaCO3,F是Na2O2,
故答案为:稀盐酸;CaCO3;Na2O2;
(2)试管中盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,反应方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,
F中二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应方程式为:2Na2 O2 +2CO2 =2Na2 CO3 +O2 ,
F中水和过氧化钠反应生成氢氧化钠和氢气,反应方程式为:2Na2 O2 +2H2O=4NaOH+O2 ↑,
D和G中蜡烛燃烧生成二氧化碳和水,设蜡烛分子式为CxHy,燃烧方程式为:CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;2Na2 O2 +2CO2 =2Na2 CO3 +O2 ;2Na2 O2 +2H2O=4NaOH+O2 ↑;CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
点评:本题以化学实验设计为载体,考查了无机物的推断,根据G和D中蜡烛燃烧状况确定气体的性质结合F进行解答,难度中等.

练习册系列答案
相关题目
用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体A.气体A完全燃烧时,需要3.5倍体积的氧气,则金属钠与碳化钙的物质的量之比是( )
| A、2:1 | B、1:2 |
| C、4:1 | D、1:4 |
120℃时,1L某气态烃在9L氧气中充分燃烧反应后的混合气体体积仍为10L(相同条件下),则该烃可能是( )
| A、CH4 |
| B、C2H6 |
| C、C2H2 |
| D、C6H6 |
某混合物中可能含有CuCl2、BaCl2、NaCl、K2CO3、K2SO4中的一种或几种.取混合物少许,加水振荡后得到无色透明溶液,向溶液中加入过量的HNO3有气体产生,再向反应的溶液中加入AgNO3溶液生成白色沉淀,则此混合物可能是( )
| A、由CuCl2和K2SO4组成 |
| B、由K2CO3和K2SO4组成 |
| C、由NaCl和K2SO4组成 |
| D、由BaCl2和K2CO3组成 |