题目内容
下列离子方程式的书写正确的是( )
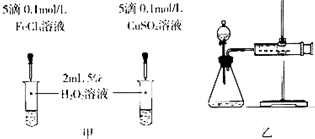
| A、金属钠投入到水中:2Na+2H2O=2Na++OH-+H2↑ | ||||
B、实验室制氯气:MnO2+2H++2Cl-
| ||||
| C、铜与浓硫酸反应:Cu+2H+=Cu2++H2↑ | ||||
| D、金属铝投入氢氧化钠溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
考点:离子方程式的书写
专题:
分析:A.电荷不守恒;
B.电荷不守恒;
C.不符合反应的客观事实;
D.金属铝投入氢氧化钠溶液中反应生成偏铝酸钠和氢气.
B.电荷不守恒;
C.不符合反应的客观事实;
D.金属铝投入氢氧化钠溶液中反应生成偏铝酸钠和氢气.
解答:
解:A.金属钠投入到水中,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.实验室制氯气,离子方程式:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故B错误;
C.浓硫酸具有强的氧化性,与金属反应不生成氢气,故C错误;
D.金属铝投入氢氧化钠溶液中,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D正确;
故选:D.
B.实验室制氯气,离子方程式:MnO2+4H++2Cl-
| ||
C.浓硫酸具有强的氧化性,与金属反应不生成氢气,故C错误;
D.金属铝投入氢氧化钠溶液中,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,是考试热点,明确反应的事实是解题关键,注意离子方程式书写应遵循客观事实和电荷守恒、原子个数守恒规律.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
已知:N2(g)+3H2(g)?2NH3(g);△H=-Q kJ?mol-1(Q>0).现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ.已知Q2=3Q1,下列叙述中正确的是( )
| A、平衡时甲容器中NH3(g)的体积分数比乙容器中的小 | ||
B、平衡时甲容器中气体的压强为开始时压强的
| ||
| C、达到平衡时,甲容器中H2的转化率为25% | ||
D、Q1=
|
能说明氯化氢是共价化合物的事实是( )
| A、氯化氢不易分解 |
| B、液态氯化氢不导电 |
| C、氯化氢溶于水发生电离 |
| D、氯化氢水溶液显酸性 |
近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾(分散质粒子直径在10-9~10-7m)属于下列哪种分散系( )
| A、悬浊液 | B、溶液 |
| C、胶体 | D、乳浊液 |
下列说法中正确的是( )
| A、互为手性异构体的分子互为镜像,且分子组成相同,性质也相同 |
| B、由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH |
| C、由AgCl和AgBr都能溶于氨水中,而AgI不能溶解在氨水中,可知AgI在水中的溶解度更大 |
| D、除HF外,其他卤化氢沸点随相对分子质量增大而升高,是因为氢键的键能逐渐增大所致 |
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述正确的是( )
| A、H2Y在电离时:H2Y+H2O?HY-+H3O+ |
| B、在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+) |
| C、在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
| D、HY-水解方程式为:HY-+H2O?Y2-+H3O+ |
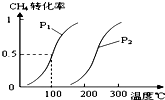 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.