题目内容
 (1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:
(1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:(2)电解原理在化学工业中有着广泛的应用.
现将你设计的原电池通过导线与如图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为:
通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
考点:电解原理
专题:电化学专题
分析:(1)氢氧燃料碱性电池中,负极上氢气失去电子;
(2)①若X和Y均为惰性电极,a为CuSO4溶液,电解时,X电极上铜离子放电、Y电极上氢氧根离子放电;要使溶液恢复原状,应该根据“析出什么加入什么”原则加入物质,根据Cu和转移电子之间的关系式计算;
②若X、Y分别为铁和铜,a仍为CuSO4溶液,Y电极上铜失电子发生氧化反应.
(2)①若X和Y均为惰性电极,a为CuSO4溶液,电解时,X电极上铜离子放电、Y电极上氢氧根离子放电;要使溶液恢复原状,应该根据“析出什么加入什么”原则加入物质,根据Cu和转移电子之间的关系式计算;
②若X、Y分别为铁和铜,a仍为CuSO4溶液,Y电极上铜失电子发生氧化反应.
解答:
解:(1)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O.
(2)①若X和Y均为惰性电极,a为CuSO4溶液,电解时,X电极上铜离子放电、Y电极上氢氧根离子放电,所以电池反应式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4;加入0.2molCuO能使溶液恢复原状,说明电解过程中只生成氧气和铜,根据Cu原子守恒得n(CuO)=n(Cu)=0.2mol,根据Cu和转移电子之间的关系知,转移电子的物质的量=0.2mol×2=0.4mol,
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;0.4mol;
②若X、Y分别为铁和铜,a仍为CuSO4溶液,Y电极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
(2)①若X和Y均为惰性电极,a为CuSO4溶液,电解时,X电极上铜离子放电、Y电极上氢氧根离子放电,所以电池反应式为2CuSO4+2H2O
| ||
故答案为:2CuSO4+2H2O
| ||
②若X、Y分别为铁和铜,a仍为CuSO4溶液,Y电极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
点评:本题考查了原电池和电解池原理,根据原电池反应特点及各个电极上发生的反应来分析解答,电极反应式书写等都是考查热点,注意(3)②活泼金属作阳极时发生的电极反应,为易错点,题目难度不大.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
用含锌、银杂质的粗铜作阳极,纯铜作阴极,CuSO4溶液做电解液进行电解,下列有关电解液中Cu2+物质的量浓度的叙述中,正确的是( )
| A、c(Cu2+)增大 |
| B、c(Cu2+)减小 |
| C、c(Cu2+)不变 |
| D、无法确定 |
下列说法正确的是( )
| A、所有自发进行的化学反应都是放热反应 |
| B、自发过程将导致体系的熵增大 |
| C、△H-T△S<0反应能自发进行 |
| D、同一物质的固、液、气三种状态的熵相同 |
下列变化中,必须加入氧化剂才能发生的是( )
| A、SO2→S |
| B、SO32-→SO2 |
| C、HCO3-→CO32- |
| D、Cl-→Cl2 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,0.1NA个HCl分子的体积为2.24L |
| B、标准状况下,22.4L 氖气含有2NA 个原子 |
| C、1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA |
| D、1 mol氖中含有的电子数为10NA |
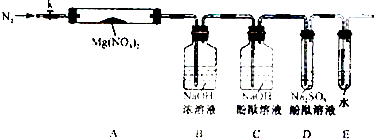 固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想: