题目内容
7.为确定某铁的氧化物粉末和铝粉形成的混合物的组成,进行下列实验.(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成气体(标准状况,下同)的体积为b L.反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑;样品中铝的质量是$\frac{9b}{11.2}$g.
(2)取等质量样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,c:b=4:5,则铁的氧化物的化学式为Fe4O5.
分析 (1)铝和NaOH反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=$\frac{aL}{22.4L/mol}$,根据化学方程式计算;
(2)设铁的氧化物的化学式为FexOy,Al与铁的氧化物反应生成Fe,Fe与盐酸反应生成氢气,根据氢气计算铁的物质的量,结合反应方程式计算.
解答 解:(1)铝和NaOH反应生成偏铝酸钠和氢气,其化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2)=$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) $\frac{b}{22.4}$mol
n(Al)=$\frac{b}{33.6}$mol,
m(Al)=27g/mol×$\frac{b}{33.6}$mol=$\frac{9b}{11.2}$g,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑; $\frac{9b}{11.2}$;
(2)设铁的氧化物的化学式为FexOy,Al与铁的氧化物反应生成Fe,发生:2yAl+3FexOy$\frac{\underline{\;高温\;}}{\;}$3xFe+yAl2O3,
已知c:b=4:5,设Al与盐酸反应生成5mol氢气,则Fe与盐酸反应生成4mol氢气;
所以n(Al)=$\frac{2}{3}$n(H2)=$\frac{10}{3}$mol,n(Fe)=4mol,
由方程式可知,2yAl~~~3xFe
2y 3x
$\frac{10}{3}$mol 4mol
所以x:y=4:5,即铁的氧化物的化学式为Fe4O5;
故答案为:Fe4O5.
点评 本题考查铝热反应以及化学方程式的计算,题目难度中等,本题注意铝热反应的原理,注意相关方程式的书写以及物质的量应用于化学方程式的计算方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案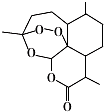
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑦⑧ |
| A. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 | |
| B. | 用一定量的锌片和足量的稀硫酸反应制氢气时,加入少量氧化铜,可以加快反应的速率且生成氢气的总量不变 | |
| C. | 燃烧一定是放热反应,也是氧化还原反应 | |
| D. | 化学反应中能量变化的大小与反应物的状态无关 |
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 离子半径r(R3-)>r(X+)>r(Z3+) | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | Y的含氧酸的酸性一定比R的含氧酸的酸性强 |
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “神舟十号”宇宙飞船返回舱外表面主要是导电导热良好的新型金属材料钛合金 | |
| C. | “天宫一号”是中国第一个空间实验室,其太阳能电池板的主要材料是硅 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |