题目内容
氯酸钾是一种强氧化剂,多用来制造火柴和烟花等.制取氯酸钾的方法有两种:第一种,无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾.
①电解池中电极反应的方程式是
阴极: ,阳极: .
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 .
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾.
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 .
④已知下列各物质的价格如下表:
从经济效益分析,上述方法中的第 种方法更好,理由是 .
①电解池中电极反应的方程式是
阴极:
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾.
③第二种方法中制得氯酸钾的化学方程式是
④已知下列各物质的价格如下表:
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
考点:电解原理
专题:电化学专题
分析:①惰性电极电解氯化钾溶液,依据离子放电顺序,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气;
②氯气和氢氧化钾溶液反应生成氯化钾、氯酸钾和水,配平写出化学方程式,依据电子守恒标注电子转移;
③电解后氯化钠溶液中的一种产物是氯气和氢氧化钠反应生成氯化钠、氯酸钠和水,氯酸钠与等物质的量的氯化钾水溶液混合,依据溶解度不同制得溶解度最小的氯酸钾;
④第一种方法原料利用率低,氯化钾的价格高,经济效益低.
②氯气和氢氧化钾溶液反应生成氯化钾、氯酸钾和水,配平写出化学方程式,依据电子守恒标注电子转移;
③电解后氯化钠溶液中的一种产物是氯气和氢氧化钠反应生成氯化钠、氯酸钠和水,氯酸钠与等物质的量的氯化钾水溶液混合,依据溶解度不同制得溶解度最小的氯酸钾;
④第一种方法原料利用率低,氯化钾的价格高,经济效益低.
解答:
解:①惰性电极电解氯化钾溶液,依据离子放电顺序,阳极是氯离子失电子生成氯气,电极反应为:2Cl--2e-═Cl2↑;
阴极是氢离子得到电子生成氢气为2H++2e-═H2↑;
故答案为:2H++2e-═H2↑;2Cl--2e-═Cl2↑;
②氯气和氢氧化钾溶液反应生成氯化钾、氯酸钾和水,反应的化学方程式标注电子转移得到为: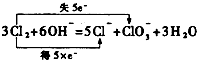 ,
,
故答案为: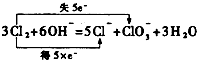 ;
;
③电解后氯化钠溶液中的一种产物是氯气和氢氧化钠反应生成氯化钠、氯酸钠和水,氯酸钠与等物质的量的氯化钾水溶液混合,依据溶解度不同制得溶解度最小的氯酸钾,反应的化学方程式为:NaClO3+KCl═KClO3+NaCl,
故答案为:NaClO3+KCl═KClO3+NaCl;四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行;
④分析反应过程可知利用电解氯化钾溶液生成的氯气和氢氧化钾反应生成氯酸钾时,氯化钾的利用率为
,电解氯化钠溶液生成的氯酸钠和氯化钾反应,氯化钾全部利用,图表分析氯化钾价格比氯化钠价格高出三倍多,第一种方法经济效益低,第二种方法更好;
故答案为:二;第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的.
阴极是氢离子得到电子生成氢气为2H++2e-═H2↑;
故答案为:2H++2e-═H2↑;2Cl--2e-═Cl2↑;
②氯气和氢氧化钾溶液反应生成氯化钾、氯酸钾和水,反应的化学方程式标注电子转移得到为:
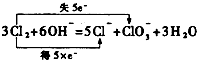 ,
,故答案为:
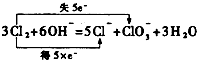 ;
;③电解后氯化钠溶液中的一种产物是氯气和氢氧化钠反应生成氯化钠、氯酸钠和水,氯酸钠与等物质的量的氯化钾水溶液混合,依据溶解度不同制得溶解度最小的氯酸钾,反应的化学方程式为:NaClO3+KCl═KClO3+NaCl,
故答案为:NaClO3+KCl═KClO3+NaCl;四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行;
④分析反应过程可知利用电解氯化钾溶液生成的氯气和氢氧化钾反应生成氯酸钾时,氯化钾的利用率为
| 1 |
| 6 |
故答案为:二;第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的.
点评:本题考查了电解原理的分析应用,工业生产的经济效益分析方法,氧化还原反应电子转移的标注方法,题目难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
设NA为阿伏加德罗常数,以下叙述正确的是( )
| A、23 g钠在氧气中完全燃烧失去电子数为NA |
| B、标准状况下,22.4L已烷所含碳原子数为6NA |
| C、20℃、1.01×105Pa时,1.6gC2H4和1.2g CO的混合气体,含气体分子数为0.1NA |
| D、0.1L 3mol?L-1的Al2(SO4)3溶液中含有的Al3+数目为0.6NA |
高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| 放电 |
| 充电 |
| A、放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B、充电时阴极反应为:Fe(OH)3-3e-+5 OH-═FeO42-+4H2O |
| C、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| D、充电时阳极附近溶液的碱性增强 |
