题目内容
13.为研究有机物A的组成与结构,进行了如下实验:①称取A18.0g,升温使其汽化,测其密度是相同条件下H2的45倍;
②称取9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g
③另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)
④A的核磁共振氢谱中,氢原子个数比为1:2:2:1
综上所述,A的结构简式为HOCH2CH2COOH.
分析 有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,浓硫酸可以吸收水,碱石灰可以吸收二氧化碳,根据元素守恒来确定有机物的分子式;羧基可以和碳酸氢钠发生化学反应生成二氧化碳,羟基可以和金属钠发生化学反应生成氢气;结合核磁共振氢谱中,氢原子个数比为1:2:2:1可确定结构简式.
解答 解:①有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为45×2=90;
②浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量是$\frac{5.4g}{18g/mol}$=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是$\frac{13.2g}{44g/mol}$=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3;
③9.0gA的物质的量=$\frac{9.0g}{90g/mol}$=0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以含有一个羧基;
醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),
n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,
④A的核磁共振氢谱中,氢原子个数比为1:2:2:1,则结构简式应为HOCH2CH2COOH,
故答案为:HOCH2CH2COOH.
点评 本题为有机物的结构和性质知识的综合推断题,为高考常见题型,考查学生对知识的整合能力,难度中等,注意根据A和碳酸氢钠、钠反应时生成气体体积判断含有的官能团.

| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 纯碱可用于清洗油污 | |
| C. | 侯式制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 |
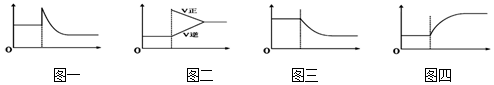
| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |

(1)装置图1中A的名称是蒸馏烧瓶.A 中一般要加入碎瓷片,其作用是防暴沸.下列关于以上实验操作说法一定正确的是D
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险.
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出.
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度.
D.图4实验中,当加热至有较多固体析出时,即停止加热.
(2)现有一瓶A和B的混合液,已知它们的性质如表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
 )有多种同分异构体,其中属于羧酸和酯类,且分子结构中含有甲基和苯环的同分异构体有( )
)有多种同分异构体,其中属于羧酸和酯类,且分子结构中含有甲基和苯环的同分异构体有( )| A. | 5种 | B. | 6种 | C. | 8种 | D. | 10种 |
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | 16O和18O | ||
| C. | H2O和H2O2 | D. | O3和O2 |