题目内容
13.已知实验室在加热条件下制取Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.现将8.7g MnO2投入200g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:(1)标准状况下生成Cl2的体积为多少?
(2)反应的HCl的分子数为为多少?
(3)向反应后的溶液中加入足量的AgNO3溶液,可生成白色沉淀的物质的量为多少?
分析 (1)根据n=$\frac{m}{M}$计算出8.7g二氧化锰的物质的量,然后根据反应方程式计算出生成氯气的物质的量,再根据V=nVm计算出生成氯气在标准状况下的体积;
(2)根据二氧化锰的物质的量及反应方程式计算出消耗HCl的物质的量,然后根据N=nNA计算出消耗HCl的分子数;
(3)先计算出HCl的质量,然后根据n=$\frac{m}{M}$计算出原浓盐酸中含有HCl的物质的量,再根据Cl元素守恒及生成氯气的物质的量计算出反应后溶液中氯离子的物质的量,生成氯化银沉淀的物质的量等于氯离子的物质的量.
解答 解:(1)盐酸过量,二氧化锰完全反应,8.7g二氧化锰的物质的量为:$\frac{8.7g}{87g/mol}$=0.1mol,根据反应可知,生成氯气的物质的量为:n(Cl2)=-n(MnO2)=0.1mol,标准状况下0.1mol氯气的体积为:22.4L/mol×0.1mol=2.24L,
答:标准状况下生成Cl2的体积为2.24L;
(2)0.1mol二氧化锰完全反应消耗HCl的物质的量为:n(HCl)=4n(MnO2)=0.1mol×4=0.4mol,则消耗HCl的分子数为0.4NA,
答:反应消耗HCl的分子数为0.4NA;
(3)200g质量分数为36.5%(过量)的浓盐酸中含有HCl的物质的量为:$\frac{200g×36.5%}{36.5g/mol}$=2mol,
根据Cl元素守恒可知反应后溶液中含有氯离子的物质的量为:2mol-0.1mol×2=1.8mol,
向反应后溶液中加入足量的硝酸银溶液,则反应生成氯化银的物质的量为1.8mol,
答:反应后生成氯化银沉淀的物质的量为1.8mol.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、阿伏伽德罗常数、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
②900℃时该反应的平衡常数K=$\frac{1}{3}$
③下列能判断实验Ⅱ已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
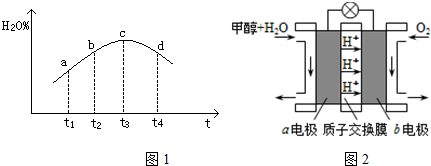
④若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,则b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(3)利用CO与H2可直接合成甲醇,图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时正极的电极反应式O2+4e-+4H+=2H2O,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
| A. | Cl-的结构示意图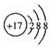 | |
| B. | S2-的结构示意图: | |
| C. | 纯碱的化学式:NaHCO3 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |

| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 7:1 |
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)最高价氧化物对应的水化物碱性最强的是NaOH(填化学式).
(3)Al的原子结构示意图为
 .
.(4)S和Cl相比,元素非金属性较强的是Cl.
(5)可用来制造光导纤维的物质是二氧化硅(或SiO2),晶体硅的主要用途是制造半导体材料(写出一种).
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.