题目内容
16.有一质量为m g,相对分子质量为M的某种强碱M (OH)2,在一定温度下,完全溶解在水中得到V mL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为$\frac{2000m}{MV}$mol/L,溶质的质量分数为$\frac{100m}{ρV}$%.分析 根据该强碱的摩尔质量计算出mg M(OH)2的物质的量,再计算出氢氧根离子的物质的量及物质的量浓度;
根据溶液的体积和密度计算出溶液的质量,根据溶质的质量分数表达式计算出所得溶液中溶质的质量分数.
解答 解:M(OH)2的摩尔质量为Mg/mol,mg该强碱的物质的量为$\frac{m}{M}$mol,含有氢氧根离子的物质的量为2×$\frac{m}{M}$mol,溶液中氢氧根离子的物质的量浓度为:$\frac{\frac{2m}{M}mol}{V×10{\;}^{-3}L}$=$\frac{2000m}{MV}$mol/L;
配制的溶液的质量为:ρg/cm3×VmL=ρVg,溶质的质量分数为:$\frac{m}{ρV}$×100%=$\frac{100m}{ρV}$%,
故答案为:$\frac{2000m}{MV}$mol/L;$\frac{100m}{ρV}$%.
点评 本题考查了物质的量浓度、溶质的质量分数的简单计算,题目难度不大,要求学生熟练掌握物质的量浓度、溶质的质量分数的计算方法.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
12.一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)?Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )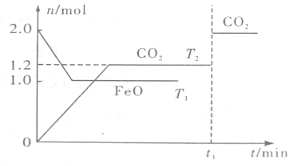

| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,T1>T2 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
7.下表是元素周期表的一部分,针对表中的①~⑨中元素,按要求用相应的化学用语填空回答.
(1)①为铍(填元素名称),在这些元素中,非金属性最强的元素Ar(填元素符号),化学性质最不活泼的原子的原子结构示意图为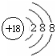 .
.
(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(离子符号表示)
(3)④⑦元素形成的化合物的电子式为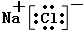
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑦⑨两元素最高价氧化物对应水化物酸性H3PO4<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑨ | ⑦ | ⑧ |
 .
.(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(离子符号表示)
(3)④⑦元素形成的化合物的电子式为
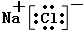
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑦⑨两元素最高价氧化物对应水化物酸性H3PO4<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
11.下列各组离子能够在指定的环境下大量共存的是( )
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、I- | |
| B. | 中性溶液中:K+、SO42-、Fe3+、Na+ | |
| C. | c(H+)/c(OH-)=10-3的溶液中:Na+、K+、CO32-、S2- | |
| D. | 水电离出的H+为10-12溶液:K+、NH4+、Cl-、HCO3- |
1.下列有关反应SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑的叙述中,正确的是( )
| A. | 氧化剂是SiO2 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 由反应可得C的还原性比Si强 | |
| D. | 若生成1 mol SiC,则转移电子2 mol |
5.下列有关乙醇的说法正确的是( )
| A. | 属于高分子化合物 | B. | 能被强氧化剂氧化 | ||
| C. | 能使石蕊试液变红 | D. | 与CH3OCH3化学性质相同 |
6.已知丁基(-C4H9)有四种结构,某烃的结构简式为  ,该烃可能的结构有( )
,该烃可能的结构有( )
 ,该烃可能的结构有( )
,该烃可能的结构有( )| A. | 16种 | B. | 14种 | C. | 12种 | D. | 10种 |
 5H3AsO4+4Br2+4K2SO4+4H2O.
5H3AsO4+4Br2+4K2SO4+4H2O.