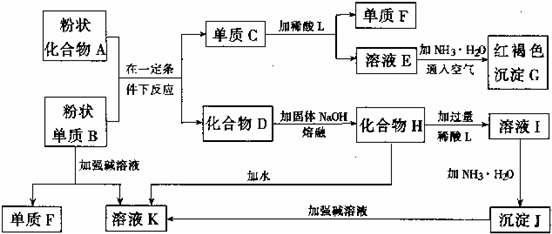
题目内容
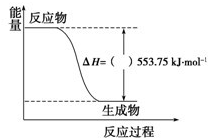 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:①如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,图中的括号内应填入
②写出表示丙烷燃烧热的热化学方程式:
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔.1mol 二甲醚完全燃烧生成CO2和液态水放出1 455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为
(2)硝化甘油(C3H5N3O9,无色液体)分解时产物为N2、CO2、O2和液态水,已知20℃时,22.7g硝化甘油分解放出的热量为154kJ,请写出它的分解反应的热化学方程式
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4
| 镁/800C/Ar |
已知:①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1
则TiO2(s)+2Cl2(g)+C(s)=TiCl4(g)+2CO(g)的△H=
考点:热化学方程式,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol;
②依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
③依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比;
(2)利用观察法配平方程式;根据方程式可知,每摩尔硝化甘油分解产生的气体,由此计算出0.1mol硝化甘油分解产生气体,根据已知,可求出生成1mol气体放出的热量;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
③依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比;
(2)利用观察法配平方程式;根据方程式可知,每摩尔硝化甘油分解产生的气体,由此计算出0.1mol硝化甘油分解产生气体,根据已知,可求出生成1mol气体放出的热量;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答:
解:(1)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;
故答案为:-;
②丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol;
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol;
③1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3;
故答案为:1:3;
(2)配平方程式得:4C3H5N3O9
6N2+12CO2+O2+10H2O;硝化甘油的摩尔质量为227g/mol,
22.7g硝化甘油的物质的量为0.1mol,放出154KJ能量,4mol硝化甘油分解放热6160KJ;
热化学方程式为:4 C3H5N3O9(l)
6N2(g)12CO2(g)+O2(g)+10H2O(l);△H =-6160 KJ/mol;
故答案为:4 C3H5N3O9(l)
6N2(g)12CO2(g)+O2(g)+10H2O(l);△H =-6160 KJ/mol;
(3)①C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566KJ/L
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141KJ/mol;
依据盖斯定律①×2-②+③得到:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=-80KJ/mol;
故答案为:-80KJ/mol.
故答案为:-;
②丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol;
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol;
③1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3;
故答案为:1:3;
(2)配平方程式得:4C3H5N3O9
| ||
22.7g硝化甘油的物质的量为0.1mol,放出154KJ能量,4mol硝化甘油分解放热6160KJ;
热化学方程式为:4 C3H5N3O9(l)
| ||
故答案为:4 C3H5N3O9(l)
| ||
(3)①C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566KJ/L
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141KJ/mol;
依据盖斯定律①×2-②+③得到:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=-80KJ/mol;
故答案为:-80KJ/mol.
点评:本题考查了热化学方程式的书写方法,盖斯定律的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列物质中不能有两种单质直接反应生成的是( )
| A、Na2O |
| B、Na2O2 |
| C、Fe3O4 |
| D、FeCl2 |
下列化学反应的有机产物中,存在同分异构体的是( )
| A、(CH3)2CHCH2Br在碱性溶液中水解 |
| B、苯在催化剂FeCl3作用下与Cl2反应 |
C、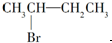 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 |
D、 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
关于醋酸的下列说法不正确的是( )
| A、既能与有机物反应又能与无机物反应 |
| B、既能发生复分解反应又能发生水解反应 |
| C、既能发生置换反应又能发生酯化反应 |
| D、既能发生取代反应又能发生氧化还原反应 |
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用.下列说法正确的是( )
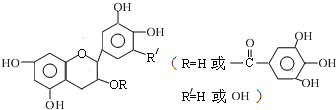

| A、常温下,儿茶素不溶于水,也不溶于有机溶剂 |
| B、儿茶素能与FeCl3溶液发生显色反应 |
| C、1mol儿茶素最多可与9mol NaOH反应 |
| D、儿茶素一定不能发生水解反应 |