题目内容
在盛有氯化铜、氯化亚铁和氯化铁混合溶液的容器中加入铁粉和铜粉,讨论以下几种情况阳离子或金属单质存在:(用Cu、Fe、Fe2+、Cu2+、Fe3+等化学用语回答)
(1)反应后有铁剩余,则容器中固体还可能有 .
(2)反应后铜有剩余且有相当数量的Fe2+,则溶液中可能存在 .
(3)反应后溶液中有相当数量的Cu2+,则还可能有 .
(4)若反应后容器中除有相当数量的铜离子外,若还有相当数量的铜,则一定不存在的有 ;若有相当数量的Fe3+存在,则一定不存在 .
(1)反应后有铁剩余,则容器中固体还可能有
(2)反应后铜有剩余且有相当数量的Fe2+,则溶液中可能存在
(3)反应后溶液中有相当数量的Cu2+,则还可能有
(4)若反应后容器中除有相当数量的铜离子外,若还有相当数量的铜,则一定不存在的有
考点:常见金属元素的单质及其化合物的综合应用,铁盐和亚铁盐的相互转变
专题:几种重要的金属及其化合物
分析:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁和铜都能与氯化铁溶液反应.氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,Fe有剩余,则Cu没有参加反应,溶液中不存在Fe3+、Cu2+,以此解答该题.
解答:
解:氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,
(1)反应后铁有剩余,发生Fe+2FeCl3=3FeCl2,Fe+CuCl2=Cu+FeCl2,Fe3+、Cu2+都不能存在,容器中剩余固体还可能含有Cu,故答案为:Cu;
(2)反应后铜有剩余,说明一定不含有Fe3+、且有相当数量的Fe2+,可能含有Cu2+,故答案为:Cu2+;
(3)反应后溶液中有相当数量的Cu2+,由于Cu2+可氧化单质铁,则不可能有Fe,容器中可能有Fe3+、Fe2+或Cu、Fe2+,故答案为:Fe3+、Fe2+或Cu、Fe2+;
(4)若反应后容器中除有相当数量的铜离子外,若还有相当数量的铜,容器中一定不存在Fe3+,Fe;
若有相当数量的Fe3+存在,发生Fe+2FeCl3=3FeCl2,Cu+2FeCl3=CuCl2+2FeCl2,Fe、Cu都不能存在,故答案为:Fe、Fe3+;Fe、Cu.
(1)反应后铁有剩余,发生Fe+2FeCl3=3FeCl2,Fe+CuCl2=Cu+FeCl2,Fe3+、Cu2+都不能存在,容器中剩余固体还可能含有Cu,故答案为:Cu;
(2)反应后铜有剩余,说明一定不含有Fe3+、且有相当数量的Fe2+,可能含有Cu2+,故答案为:Cu2+;
(3)反应后溶液中有相当数量的Cu2+,由于Cu2+可氧化单质铁,则不可能有Fe,容器中可能有Fe3+、Fe2+或Cu、Fe2+,故答案为:Fe3+、Fe2+或Cu、Fe2+;
(4)若反应后容器中除有相当数量的铜离子外,若还有相当数量的铜,容器中一定不存在Fe3+,Fe;
若有相当数量的Fe3+存在,发生Fe+2FeCl3=3FeCl2,Cu+2FeCl3=CuCl2+2FeCl2,Fe、Cu都不能存在,故答案为:Fe、Fe3+;Fe、Cu.
点评:本题考查氧化还原反应以及铁的单质化合物的性质,题目难度中等,本题关键是把握物质的氧化性、还原性强弱判断反应的先后顺序.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列叙述不正确的是( )
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、将地下钢管与直流电源的正极相连,用来保护钢管 |
| C、电解饱和食盐水制氢氧化钠,可以用铁做阴极 |
| D、氢氧燃料电池中,氢气在负极发生氧化反应 |
分离饱和食盐水与沙子的混合物,可选用的分离方法为( )
| A、萃取分液法 | B、加热分解法 |
| C、蒸馏法 | D、过滤法 |
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.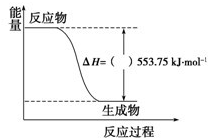 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: