题目内容
5. 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.(1)写出基态E原子的价电子排布式3d54s1.
(2)B、C、D三种元素第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 sp3,分子的立体结构为三角锥形;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式
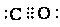 .
.(4)A2D的沸点在同族元素中最高,其原因是由于水分子间形成氢键,导致沸点升高.A2D由液态形成晶体时密度 减小(填“增大”、“不变”或“减小”),其主要原因水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小 (用文字叙述).
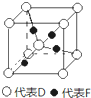
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为Cu2O(用元素符号表示)
分析 周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,A的原子序数是六种元素中的最小的,则A为H元素;B的一种核素在考古时常用来鉴定一些文物的年代,则B为C元素,D原子核外电子有8种不同的运动状态,则D为O元素,C元素原子的最外层有3个自旋方向相同的未成对电子,C原子序数介于B和D之间,所以C为N,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,则E为Cr,F元素位于周期表的ds区,其基态原子最外能层只有一个电子,则F为Cu,据此答题.
解答 解:周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,A的原子序数是六种元素中的最小的,则A为H元素;B的一种核素在考古时常用来鉴定一些文物的年代,则B为C元素,D原子核外电子有8种不同的运动状态,则D为O元素,C元素原子的最外层有3个自旋方向相同的未成对电子,C原子序数介于B和D之间,所以C为N,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,则E为Cr,F元素位于周期表的ds区,其基态原子最外能层只有一个电子,则F为Cu,
(1)E为Cr,基态E原子的价电子为了,价电子排布式为3d54s1,
故答案为:3d54s1;
(2)B、C、D三种元素第一电同周期随原子序数增大,第一电离能呈增大趋势,氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:C<O<N,
故答案为:C<O<N;
(3)A与C形成CA3型分子为NH3,NH3分子中N原子价层电子对数为$\frac{5+3}{2}$=4,所以N原子杂化类型为sp3杂化,有一对孤电子对,所以分子的立体结构为三角锥形,N2的单质与化合物CO是等电子体,根据等电子体原理,它们的结构相似,所以CO的电子式为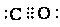
故答案为:sp3;三角锥形;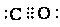
(4)H2O的沸点在同族元素中最高,其原因是由于水分子间形成氢键,导致沸点升高,H2O由液态形成晶体时密度减小,是因为水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小,
故答案为:由于水分子间形成氢键,导致沸点升高;减小;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;
(5)根据均摊法可知,在晶胞中含有氧原子数为1+8×$\frac{1}{8}$=2,铜原子数为4,所以氧原子和铜原子数之比为1:2,所以化学式为Cu2O,
故答案为:Cu2O.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、等电子体、杂化方式、晶胞计算等,注意理解均摊法进行晶胞有关计算,理解同周期第一电离能异常情况,难度中等.

| A. | .质子数等于电子数的某微粒,可能是一种分子或一种离子 | |
| B. | 只由一种分子组成的物质一定为纯净物 | |
| C. | 3517Cl与3717Cl互为同位素 | |
| D. | 1molNa2O2晶体与1molNa2O晶体中所含阴阳离子总数相等 |
| A. | 浓硫酸、水 | B. | 饱和食盐水、浓H2SO4 | ||
| C. | 烧碱、石灰水 | D. | 无水CaCl2、烧碱 |
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、Br2 |
| ③ | MnO2… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第③组反应中生成1mol Cl2,转移电子4mol | |
| C. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为3:2 |
| A. | Fe分别与氯气和稀盐酸反应所得氯化物不同 | |
| B. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| C. | SO2、NO2都能与水反应,其反应原理相同 | |
| D. | N2的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 |
①CO、NO、P2O5均为酸性氧化物
②Ca(HCO3)2、SO3、FeCl3均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤烧碱、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质.
| A. | ①②③⑤ | B. | ②③⑤ | C. | ②③ | D. | 全部 |
| A. | SO2 | B. | Ca(ClO)2 | C. | NaClO | D. | H2SO4(浓) |
| A. |  图除去CO2中的HCl | |
| B. |  图装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  图所示装置制取并收集干燥纯净的NH3 | |
| D. | 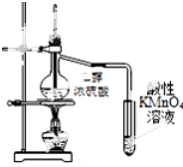 图证明CH3CH2OH发生消去反应生成了乙烯 |
| A. | NaHSO4溶液与NaOH溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与石灰乳混合 | D. | Na2HPO4溶液与NaOH溶液混合 |