题目内容
15.下列反应中,不属于化合、分解、置换、复分解等四种基本反应类型的是( )| A. | CuSO4+H2S═CuS↓+H2SO4 | |
| B. | 2FeCl3+Cu═2FeCl2+CuCl2 | |
| C. | .Cu2 (OH)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | |
| D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
分析 化合反应指的是由两种或两种以上的物质生成一种新物质的化合反应;
分解反应是指一种化合物在特定条件下,分解成二种或二种以上较简单的单质或化合物的反应;
复分解反应指由两种化合物互相交换成分,生成另外两种化合物的反应;
置换反应是一种单质与一种化合物反应生成另外的一种单质和另外一种化合物的化学反应.
解答 解:A.该反应由两种化合物相互交换成分生成另外的化合物,为复分解反应,故A错误;
B.该反应由一种单质和一种化合物反应生成另外的两种化合物,不属于化合、分解、置换、复分解等四种基本反应类型,但属于氧化还原反应,故B正确;
C.该反应由一种物质生成三种物质,为分解反应,故C错误;
D.该反应由三种物质生成一种物质,为化合反应,故D错误;
故选B.
点评 本题考查了化学基本反应类型的判断,明确这四个概念的内涵是解本题关键,根据概念来判断即可,难度不大.

练习册系列答案
相关题目
5.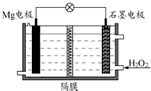 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )| A. | 电池工作时,石墨周围海水的pH减少 | |
| B. | 电池工作时,溶液中的H+向负极移动 | |
| C. | 电池总反应为Mg+H2O2+2H+═Mg2++2H2O | |
| D. | Mg电极是该电池的正极 |
6.用锌块与20mL3mol•L-1硫酸反应制取H2,若要增大反应速率,可采取的措施是①再加入20mL同浓度的稀硫酸 ②加入几滴CuSO4溶液 ③改用粉末状锌 ④适当升高温( )
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
3.下列可能大量共存且溶液是无色的离子组是( )
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
10.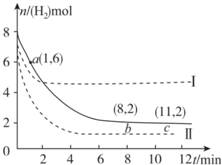 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是减少压强 | |
| D. | T℃时,该反应的化学平衡常数为0.125 |
20.将0.51 mol铜与250 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.待产生的气体全部释放后,向溶液中加入300 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是( )
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
7.下列反应所得溶液中一定只含一种溶质的是( )
| A. | 向铁粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入过量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2气体 | |
| D. | 将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合 |
4.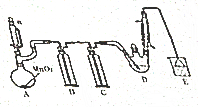 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
①制备反应原理:C2H5OH+4Cl2→CCl4CHO+5HCl
可能发生副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
(1)仪器A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B中的试剂是饱和食盐水
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:①制备反应原理:C2H5OH+4Cl2→CCl4CHO+5HCl
可能发生副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
18.下列说法中错误的是( )
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |