题目内容
取配制好的Na2SO4溶液(物质的量浓度为2mol/L)200mL,要将其浓度降低为1mol?L-1.
①若将原溶液中加水稀释,计算所需蒸馏水的体积.
②若向原溶液中加入1mol?L-1 的BaCl2溶液,计算需加入BaCl2溶液的体积.(计算时不考虑溶液体积的变化)
①若将原溶液中加水稀释,计算所需蒸馏水的体积.
②若向原溶液中加入1mol?L-1 的BaCl2溶液,计算需加入BaCl2溶液的体积.(计算时不考虑溶液体积的变化)
考点:配制一定物质的量浓度的溶液,物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:①根据c1V1=c2V2计算出稀释后的溶液体积,再计算出需要加入蒸馏水的体积;
②根据氯化钡与硫酸钠反应的方程式计算出需要氯化钡的物质的量及氯化钡溶液的体积.
②根据氯化钡与硫酸钠反应的方程式计算出需要氯化钡的物质的量及氯化钡溶液的体积.
解答:
解:①200mL 2mol/L的硫酸钠稀释成1mol/L的硫酸钠,稀释后硫酸钠溶液的体积为:V=
=0.4L=400mL,还需要加入的蒸馏水的体积为:400mL-200mL=200mL,
答:需要蒸馏水的体积为200mL或0.2L;
②氯化钡与硫酸钠反应生成硫酸钡沉淀,反应的关系式为:BaCl2~Na2SO4,反应的硫酸钠与氯化钡的物质的量相等,消耗氯化钡的物质的量为:2mol/L×0.2L=0.4mol,需要1mol/L的氯化钡溶液的体积为:
=0.4L=400mL,
答:需加入BaCl2溶液的体积为400mL或0.4L.
| 2mol/L×0.2mol |
| 1mol/L |
答:需要蒸馏水的体积为200mL或0.2L;
②氯化钡与硫酸钠反应生成硫酸钡沉淀,反应的关系式为:BaCl2~Na2SO4,反应的硫酸钠与氯化钡的物质的量相等,消耗氯化钡的物质的量为:2mol/L×0.2L=0.4mol,需要1mol/L的氯化钡溶液的体积为:
| 0.4mol |
| 1mol/L |
答:需加入BaCl2溶液的体积为400mL或0.4L.
点评:本题考查了有关物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确溶液稀释过程中溶质的物质的量不变是解答本题关键.

练习册系列答案
相关题目
下列能大量共存的离子组是( )
| A、Na+ H+ HCO3- Cl- |
| B、K+ Ca2+ HCO3- OH- |
| C、Na+ K+ CO32- Cl- |
| D、Na+ K+ HCO3-CO32- |
下列分子中不含π键只含δ键的是( )
| A、HC≡CH |
| B、CH4 |
| C、N≡N |
| D、CO2 |
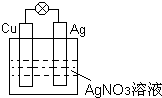 I.①如图所示,负极材料是
I.①如图所示,负极材料是