题目内容
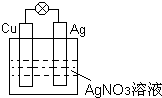 I.①如图所示,负极材料是
I.①如图所示,负极材料是②工业上用
II.已知:
①CaCO3(s)═CaO (s)+CO2(g)△H=+178.2kJ?mol-1
②2Na (s)+Cl2 (g)═2NaCl (s)△H=-822.0kJ?mol-1
③H-H、Cl-Cl和 H-Cl的键能分别为436kJ?mol-1、243kJ?mol-1和431kJ?mol-1
则:
(1)上述反应①②中属于放热反应的是
(2)根据②计算生成1mol NaCl(s)时,△H=
(3)根据③推算:Cl2 (g)+H2 (g)=2HCl(g)的△H=
(4)已知在101kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:I.①该原电池中,Cu易失电子作负极、Ag作正极,负极上电极反应式为Cu-2e-=Cu 2+、正极上电极反应式为Ag++e-=Ag;
②工业上用电解饱和氯化钠溶液制取氯气,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气;
II.(1)△H<0的为放热反应;
(2)生成2molNaCl放出822.0kJ热量,则生成1molNaCl放出其一半的热量;
(3)根据化学键计算反应热;
(4)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量.
②工业上用电解饱和氯化钠溶液制取氯气,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气;
II.(1)△H<0的为放热反应;
(2)生成2molNaCl放出822.0kJ热量,则生成1molNaCl放出其一半的热量;
(3)根据化学键计算反应热;
(4)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量.
解答:
解:I、①该原电池中,Cu易失电子作负极、Ag作正极,负极上电极反应式为Cu-2e-=Cu 2+、正极上电极反应式为Ag++e-=Ag,电池反应式为Cu+2Ag+=2Ag+Cu2+,
故答案为:Cu;Ag++e-=Ag;Cu+2Ag+=2Ag+Cu2+;
②工业上用电解饱和氯化钠溶液制取氯气,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,电池反应式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:电解;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
II(1)△H<0的为放热反应,所以②是放热反应,故答案为:②;
(2)生成2molNaCl放出822.0kJ热量,则生成1molNaCl放出其一半的热量,为411kJ热量,故答案为:△H=-411.0 kJ?mol-1;
(3)△H=(436kJ?mol-1+243kJ?mol-1)-2×(431kJ?mol-1)=-183.0kJ?mol-1,故答案为:-183.0;
(4)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量,则甲烷的燃烧热化学反应方程式为CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ?mol-1,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ?mol-1 .
故答案为:Cu;Ag++e-=Ag;Cu+2Ag+=2Ag+Cu2+;
②工业上用电解饱和氯化钠溶液制取氯气,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,电池反应式为2NaCl+2H2O
| ||
故答案为:电解;2NaCl+2H2O
| ||
II(1)△H<0的为放热反应,所以②是放热反应,故答案为:②;
(2)生成2molNaCl放出822.0kJ热量,则生成1molNaCl放出其一半的热量,为411kJ热量,故答案为:△H=-411.0 kJ?mol-1;
(3)△H=(436kJ?mol-1+243kJ?mol-1)-2×(431kJ?mol-1)=-183.0kJ?mol-1,故答案为:-183.0;
(4)CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则生成2mol液态水放出2QkJ的热量,则甲烷的燃烧热化学反应方程式为CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ?mol-1,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O (l)△H=-2Q kJ?mol-1 .
点评:本题考查了热化学反应方程式、原电池原理,根据盖斯定律、原电池原理等知识点来分析解答,属于基础题,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于下列图示的说法中正确的是( )
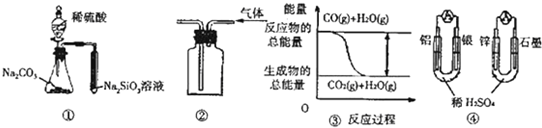

| A、用图 ①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图 ②所示实验装置排空气法收集CO2气体 |
| C、图 ③表示CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 |
| D、图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
50mL 0.1mol/L FeCl3溶液与25mL 0.2mol/L KCl溶液中的Cl-的数目之比( )
| A、5:2 | B、3:1 |
| C、2:5 | D、1:3 |
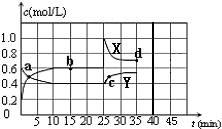 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答: