题目内容
(1)写出NaHSO4在水溶液中的电离方程式:
(2)某溶液中可能含有Cl-、SO42-、NO3-、CO32-等阴离子.
①当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是 .原因是(用离子方程式表示) .
②当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是 .
(2)某溶液中可能含有Cl-、SO42-、NO3-、CO32-等阴离子.
①当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是
②当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是
考点:电解质在水溶液中的电离,离子共存问题
专题:离子反应专题
分析:(1)NaHSO4在水溶液中的电离极性共价键在极性水分子的作用下断裂;
(2)①当溶液中有大量H+存在时,因反应2H++CO32-═H2O+CO2↑发生复分解,导致CO32-、H+不可能大量存在;
②当溶液中有大量Ba2+存在时,Ba2+与SO42-、CO32-发生复分解生成沉淀而不能共存.
(2)①当溶液中有大量H+存在时,因反应2H++CO32-═H2O+CO2↑发生复分解,导致CO32-、H+不可能大量存在;
②当溶液中有大量Ba2+存在时,Ba2+与SO42-、CO32-发生复分解生成沉淀而不能共存.
解答:
解:(1)NaHSO4在水溶液中的电离极性共价键在极性水分子的作用下断裂,电离方程式为NaHSO4═Na++H++SO42-,故答案为:NaHSO4═Na++H++SO42-;
(2))①当溶液中有大量H+存在时,因反应2H++CO32-═H2O+CO2↑发生复分解,导致CO32-、H+不可能大量存在,故答案为CO32-;2H++CO32-═H2O+CO2
②当溶液中有大量Ba2+存在时,Ba2+与SO42-、CO32-发生复分解生成沉淀而不能共存,故答案为:SO42-、CO32-.
(2))①当溶液中有大量H+存在时,因反应2H++CO32-═H2O+CO2↑发生复分解,导致CO32-、H+不可能大量存在,故答案为CO32-;2H++CO32-═H2O+CO2
②当溶液中有大量Ba2+存在时,Ba2+与SO42-、CO32-发生复分解生成沉淀而不能共存,故答案为:SO42-、CO32-.
点评:本题考查离子方程式的书写和离子共存类的问题,比较简单.

练习册系列答案
相关题目
下列各组离子中,全组离子均与氖原子电子层结构相同的是( )
| A、Na+、Mg2+、Al3+、O2-、F- |
| B、Li+、Na+、F-、O2-、Cl- |
| C、Na+、Mg2+、Al3+、K+、Ca2+ |
| D、S2-、Cl-、K+、Ca2+、Na+ |
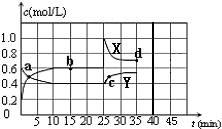 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答: