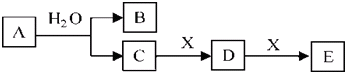
题目内容
7.一个原电池的总反应方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是( )| A | B | C | D | |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | FeCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 Zn+Cu2+=Zn2++Cu中,Zn失去电子,为原电池的负极,正极材料为比Zn不活泼的金属或惰性电极即可,电解质溶液中含铜离子,据此解答.
解答 解:原电池的总反应是Zn+Cu2+=Zn2++Cu,Zn失去电子,为原电池的负极,正极材料为比Zn不活泼的金属或惰性电极即可,电解质溶液中含铜离子,则可选Zn为负极,Cu为正极,电解质溶液为CuCl2或是CuSO4,故D正确.
故选D.
点评 本题考查原电池的设计,注意利用电池反应中得失电子分析电极,侧重考查学生的分析能力和知识的迁移能力,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
16.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 在含A13+总数为NA的A1C13溶液中,C1-总数为3NA | |
| B. | 标准状况下,5.6L CO2中含有的共用电子对数为0.5NA | |
| C. | Na2O2与足量的CO2反应生成0.1mol O2,转移的电子数为0.2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子 |
17.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 醋酸加入到碳酸钠固体中,将产生的气体通入C6H5ONa 溶液中 | 溶液变浑浊 | 酸性:CH3COOH>H2CO3>C6H5OH |
| B | CH3CH2Br 与NaOH 乙醇溶液共热产生的气体通入溴水中 | 溶液褪色 | 产生了乙烯 |
| C | 向某氯化亚铁溶液中加入加入Na2O2 粉末 | 出现红褐色沉淀 | 加入 Na2O2 粉末前,原氯化亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
15.已知下列化合物:①硝基苯 ②环己烷 ③乙苯 ④溴苯 ⑤间二硝基苯.其中能由苯通过一步反应直接制取的是( )
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | 全部 |
12.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物 质 | 试 剂 | 分 离 方 法 | |
| A. | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
| B. | 硬脂酸钠(甘油) | 饱和食盐水 | 盐析后过滤 |
| C. | KNO3(KCl) | 水 | 蒸发结晶 |
| D. | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
16.现有部分元素的性质、用途与原子(或分子)结构如表所示:
(1)元素Y在周期表中的位置第二周期ⅡA族,元素T的简单离子结构示意图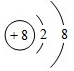 .
.
(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| W | 周期表中原子半径最小的元素 |
| X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | M层比K层少1个电子 |
| T | 存在两种同素异形体,其中一种可吸收紫外线 |
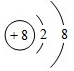 .
.(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
17. 已知:苯酚(
已知:苯酚(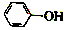 )在水中的电离方程式为
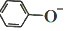
)在水中的电离方程式为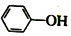 ?
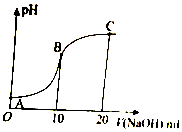
? +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
 已知:苯酚(
已知:苯酚( )在水中的电离方程式为
)在水中的电离方程式为 ?
? +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )| A. | A点溶液中,苯酚的电离度约为0.01% | |
| B. | B点溶液的pH<7 | |
| C. | C点溶液中存在c(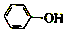 )>c(OH-)>c(H+) )>c(OH-)>c(H+) | |
| D. | A 点溶液加少量水稀释,溶液中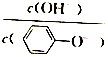 减小 减小 |
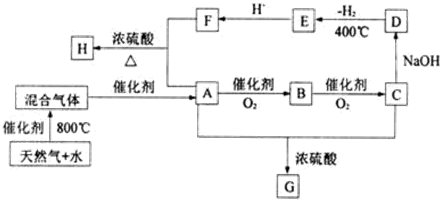
 ;E的化学式是Na2C2O4.
;E的化学式是Na2C2O4.