题目内容
6.甲烷和甲醇可以做燃料电池(如图1),具有广阔的开发和应用前景,回答下列问题:(1)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如上图所示:通入b气体的电极是原电池的正极(填“正”或“负”).通入a气体的电极反应式为CH3OH+H2O-6e-═CO2+6H+.
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示U形管中氯化钠溶液的体积为80ml.闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为7.72×103C(保留两位小数,已知法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为14.
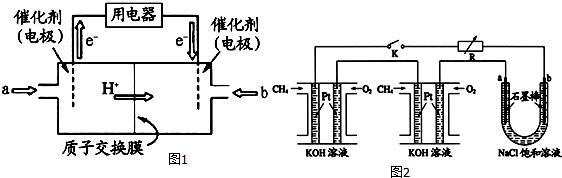
分析 (1)电子从负极流出,正极流入,燃料电池中,通入氧气的一极是正极,通入燃料的电极为负极,发生氧化反应,甲醇被氧化生成二氧化碳;
(2)电解氯化钠溶液的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH计算.
解答 解:(1)电子从负极流出,正极流入,燃料电池中,通入氧气的一极是正极,通入燃料的电极为负极,发生氧化反应,甲醇被氧化生成二氧化碳,电极方程式为:CH3OH+H2O-6e -═CO2+6H+,
故答案为:正;CH3OH+H2O-6e -═CO2+6H+;
(2)电解氯化钠溶液的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=$\frac{0.08mol}{0.08L}$=1mol/L,pH=14;电解池通过的电量为$\frac{0.224L}{22.4L•mo{l}^{-1}}$×8×9.65×104C•mol-1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),
故答案为:7.72×103C;14.
点评 本题综合考查电化学知识,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,题目难度中等.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
16.下列各组排列的顺序不正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
14.目前,我国许多城市为防止形成光化学烟雾,都已严格规定了汽车尾气的排放标准,并加强了检查力度.与光化学烟雾形成有关的是( )
| A. | 臭氧 | B. | 二氧化氮 | C. | 二氧化硫 | D. | 二氧化碳 |
1.下列有关实验操作、现象和解释或结论都正确的是( )
| 编号 | 实验操作 | 现象 | 解释或结论 |
| A | 在浓硫酸中加入过量的铁粉,充分反应后滴入KSCN溶液 | 溶液呈红色 | H2SO4将Fe氧化为Fe3+ |
| B | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生了取代反应生成了溴苯 |
| C | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| D | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
11.下列有机化合物的链状同分异构体(有且只有一种官能团)数目最多的是( )
| A. | 丁酸 | B. | 丁烯(C4H8) | C. | 二氯丁烷 | D. | 丁醇 |
18.如图是常见四种有机物的比例模型示意图,下列说法正确的是( )


| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与溴水发生加成反应使溴水褪色 | |
| C. | 丙中的碳碳键是碳碳单键和碳碳双键交替结合 | |
| D. | 丁不能使酸性高锰酸钾溶液褪色 |
16.下列能构成原电池的一组装置是( )
| A. |  | B. |  | C. |  | D. |  |
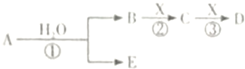 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):