题目内容
20.某天然油脂的分子式为C57H106O6.1mol该油脂水解可得到1mol甘油、1mol脂肪酸X和2mol直链饱和脂肪酸Y;经测定X的相对分子质量为280,原子个数比为C:H:O=9:16:1.下列说法错误的是( )| A. | X的分子式为C18H32O2 | |
| B. | 脂肪酸Y能发生取代反应 | |
| C. | Y的结构简式可能为CH3CH=CH(CH2)14COOH | |
| D. | Y的结构简式为CH3(CH2)16COOH |
分析 天然油脂C57H106O6的水解可以表示成:C57H106O6+3H2O→C3H8O3(甘油)+X+2Y,X的相对分子质量为280,原子个数比为C:H:O=9:16:1,设X的分子式为C9nH16nOn,n=$\frac{280}{12×9+1×16+16×1}$=2,所以X的分子式为:C18H32O2,根据原子守恒知,Y的分子式为:C18H36O2,结合Y是直链饱和脂肪酸,可知Y的结构简式为:CH3-(CH2)16-COOH,以此解答该题.
解答 解:天然油脂C57H106O6的水解可以表示成:C57H106O6+3H2O→C3H8O3(甘油)+X+2Y,X的相对分子质量为280,原子个数比为C:H:O=9:16:1,设X的分子式为C9nH16nOn,n=$\frac{280}{12×9+1×16+16×1}$=2,所以X的分子式为:C18H32O2,根据原子守恒知,Y的分子式为:C18H36O2,结合Y是直链饱和脂肪酸,可知Y的结构简式为:CH3-(CH2)16-COOH,
A.X的分子式为C18H32O2,故A正确;
B.Y的结构简式为:CH3-(CH2)16-COOH,能与醇发生酯化反应,酯化反应属于取代反应,故B正确;
C.Y是直链饱和脂肪酸,结构简式为:CH3-(CH2)16-COOH,故C错误;
D.Y的结构简式为CH3(CH2)16COOH,故D正确;
故选C.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,本题注意把握水解反应的特点,从质量守恒的角度解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法中正确的是( )
①油脂在酸性或碱性条件下均可发生水解反应,且产物相同
②由油脂得到甘油和由淀粉得到葡萄糖均发生了水解反应
③淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
④用新制的银氨溶液可区分甲酸甲酯和乙醛.
①油脂在酸性或碱性条件下均可发生水解反应,且产物相同
②由油脂得到甘油和由淀粉得到葡萄糖均发生了水解反应
③淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
④用新制的银氨溶液可区分甲酸甲酯和乙醛.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
15.下列叙述不正确的是( )
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 工业上电解饱和食盐水的阴极反应:2H++2e-═H2↑ |
5.“神舟”飞船上的太阳能帆板采用了大量先进的复合材料,以便在尽可能提高发电效能的同时,减轻其自身质量,其身价达到了上千万元.下列说法不符合事实的是( )
| A. | 复合材料的使用可以使太阳能帆板承受超高温 | |
| B. | 复合材料的使用可以使“神舟”飞船质量变轻 | |
| C. | 复合材料的使用可以使太阳能帆板承受超高强度的改变 | |
| D. | 复合材料的使用可以使太阳能帆板承受温差造成的热胀冷缩的难题 |
12.锰的单质及其化合物在生产、生活中有广泛应用.
(1)碱性锌锰电池广泛应用于日常生活.电池的总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).
该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
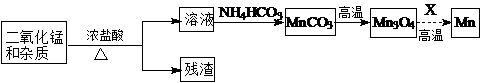
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
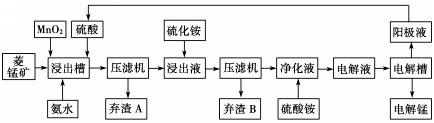
已知:NiS、CoS均难溶于水.部分氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
①浸出槽内MnO2的作用是(用离子方程式表示)MnO2+4H++2Fe2+=2Fe3++Mn2++2H2O.
②加入氨水调节浸出槽中溶液的pH范围为3.8≤pH<8.3.
③电解槽阴极的电极反应式为Mn2++2e-=Mn.
(1)碱性锌锰电池广泛应用于日常生活.电池的总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s).
该电池的正极反应式为MnO2+H2O+e-=MnOOH+OH-.
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
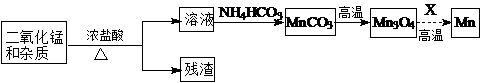
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是二氧化锰与浓盐酸反应会产生有毒的氯气.
②从产品纯度、环保等角度考虑,X宜选择C(填代号).
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式6MnCO3+O2 $\frac{\underline{\;高温\;}}{\;}$2Mn3O4+6CO2.
(3)电解硫酸锰溶液法制锰又叫湿法冶锰.以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:

已知:NiS、CoS均难溶于水.部分氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol•L-1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
②加入氨水调节浸出槽中溶液的pH范围为3.8≤pH<8.3.
③电解槽阴极的电极反应式为Mn2++2e-=Mn.
9.下列有关电池的说法不正确的是( )
| A. | 手机用的锂离子电池属于二次电池 | |
| B. | 锌锰干电池中锌电极是负极 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 汽车所用的铅蓄电池可以无限次的反复放电、充电 |
10.下列化学用语表述正确的是( )
| A. | 质子数为53、中子数为78的碘原子:13153I | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | CO2的球棍模型: | |
| D. | NH4I的电子式: |