题目内容
18.爱迪生电池在充电和放电时发生反应:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是( )①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe+2H2O-2e-═Fe(OH)2+2H+
④充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中.
| A. | ③⑤ | B. | ③④ | C. | ①③ | D. | ①⑤ |
分析 ①放电时,电解质溶液中的阴离子向负极方向移动,阳离子向正极移动;
②放电时,失电子化合价升高的物质在负极上反应、得电子化合价降低的物质在正极上反应;
③放电时,负极上失电子发生氧化反应;
④充电时,阴极上得电子发生还原反应;
⑤根据发生的反应确定电解质溶液酸碱性.
解答 解:①放电时,电解质溶液中的阴离子向负极方向移动,阳离子向正极移动,故错误;
②Fe元素化合价由0价变为+2价、Ni元素化合价由+4价变为+2价,则Fe参与负极反应,NiO2参与正极反应,故正确;
③放电时,负极上失电子发生氧化反应,电极反应式为Fe-2e-+2OH-=Fe(OH)2,故错误;
④充电时,阴极上得电子发生还原反应,电极反应式为Fe(OH)2+2e-═Fe+2OH-,故正确;
⑤由方程式可知此电池为碱性电池,反应方程式时不能出现H+,只能浸在碱性电解质溶液中,故正确;
故选C.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定各个电极上发生的反应,再结合离子移动方向来分析解答,难点是电极反应式的书写.

练习册系列答案
相关题目
8.下列有关Ba(OH)2溶液与H2SO4溶液反应的离子方程式中,书写正确的是( )
| A. | Ba(OH)2+2H++SO42-═BaSO4↓+2H2O | |
| B. | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | OH-+H+═H2O |
9.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,且有良好的超导性,下列K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性共价键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式可定成KC20 | |
| D. | C60与12C互为同素异形体 |
6.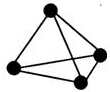 在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
 在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )
在非金属单质中,若原子间以共价单键相连,那么一个原子与相邻原子的成键数通常为8-N,N为该非金属元素的族序数.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅥA | B. | ⅢA | C. | ⅤA | D. | ⅣA |
13.下列实验的反应原理用方程式或电极反应式表示正确的是( )
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2═CO2+2H2O | |
| D. | 铅蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
10.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.2 mol•L-1 |
7.铅的氧化物较多,其中Pb3O4是铅的最高价氧化物和最低价氧化物形成的复杂氧化物.在Pb3O4中,铅的最低价氧化物与最高价氧化物的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 无法确定 |
20.某天然油脂的分子式为C57H106O6.1mol该油脂水解可得到1mol甘油、1mol脂肪酸X和2mol直链饱和脂肪酸Y;经测定X的相对分子质量为280,原子个数比为C:H:O=9:16:1.下列说法错误的是( )
| A. | X的分子式为C18H32O2 | |
| B. | 脂肪酸Y能发生取代反应 | |
| C. | Y的结构简式可能为CH3CH=CH(CH2)14COOH | |
| D. | Y的结构简式为CH3(CH2)16COOH |
 .
.