题目内容
9.下列有关电池的说法不正确的是( )| A. | 手机用的锂离子电池属于二次电池 | |
| B. | 锌锰干电池中锌电极是负极 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 汽车所用的铅蓄电池可以无限次的反复放电、充电 |
分析 A.锂离子电池可充电和放电;
B.锌锰干电池中锌失去电子;
C.甲醇燃料电池与氢氧燃料电池相似,外部提供燃料和氧化剂,提高能源利用率;
D.铅蓄电池具有一定的使用寿命.
解答 解:A.锂离子电池能充放电,属于二次电池,放电时是将化学能转化为电能,充电时是将电能转化为化学能,故A正确;
B.锌锰干电池中锌失去电子,则Zn作负极,故B正确
C.甲醇燃料电池与氢氧燃料电池相似,均为原电池装置,将化学能转化为电能,且能源利用率较高,故C正确;
D.铅蓄电池为常见的二次电池,充电电池的使用有一定年限,所以不能无限制的反复充电、放电,故D错误;
故选D.
点评 本题考查常见的化学电源,为高频考点,把握电源的种类、工作原理、能源利用等为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.铅的氧化物较多,其中Pb3O4是铅的最高价氧化物和最低价氧化物形成的复杂氧化物.在Pb3O4中,铅的最低价氧化物与最高价氧化物的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 无法确定 |
20.某天然油脂的分子式为C57H106O6.1mol该油脂水解可得到1mol甘油、1mol脂肪酸X和2mol直链饱和脂肪酸Y;经测定X的相对分子质量为280,原子个数比为C:H:O=9:16:1.下列说法错误的是( )
| A. | X的分子式为C18H32O2 | |
| B. | 脂肪酸Y能发生取代反应 | |
| C. | Y的结构简式可能为CH3CH=CH(CH2)14COOH | |
| D. | Y的结构简式为CH3(CH2)16COOH |
17.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34g/mol,则下列说法中正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 阴离子还原性:W>Q | |
| B. | X的最低价氢化物能形成分子间氢键 | |
| C. | Z能在自然界中以游离态存在 | |
| D. | Na与Y能形成化合物Na2Y2,1 mol Na2Y2与CO2反应,转移电子数为1 NA |
4.甲~辛等元素在周期表中的位置如表所示.下列说法不正确的是( )
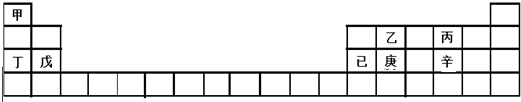

| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
14.下列有机物分子中,在氢核磁共振谱中信号强度(个数比)是1:3的是( )
| A. | 邻二甲苯 | B. | 均三甲苯 | C. | 异丙醇 | D. | 对苯二酚 |
1.下列关于药物的说法正确的是( )
| A. | 药物的服用剂量越大,治疗效果越明显 | |
| B. | 包装上印有“OTC“标志的药品属于处方药 | |
| C. | 氢氧化铝可作为抑酸剂,用于治疗胃酸过多 | |
| D. | 长期大量服用阿司匹林可预防某些疾病,没有副作用 |
18.下列溶液中一定能大量共存的离子组是( )
| A. | Mg2+、Na+、Cl-、NO3- | B. | K+、H+、NO3-、HCO3- | ||
| C. | Ba2+、K+、OH-、SO42- | D. | OH-、Al3+、Ag+、NO3- |
19.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如表:
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)根据实验3完成下列填空:
①铝为负极;
②电池总反应式:2Al+6HCl═2AlCl3+3H2↑.
(3)实验4中铝作负极,理由是铝可与氢氧化钠溶液发生氧化还原反应,而镁不与氢氧化钠溶液反应.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)根据实验3完成下列填空:
①铝为负极;
②电池总反应式:2Al+6HCl═2AlCl3+3H2↑.
(3)实验4中铝作负极,理由是铝可与氢氧化钠溶液发生氧化还原反应,而镁不与氢氧化钠溶液反应.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.