题目内容
已知在25℃时,CH3COOH、HClO、H2CO3和H2SO3的电离平衡常数分别为
CH3COOH K=1.75×10-5
HClO K=2.95×10-8
H2CO3 K1=4.30×10-7 K2=5.61×10-11
H2SO3 K1=1.54×10-2 K2=1.02×10-7
(1)写出H2CO3的第一级电离平衡常数表达式:K1= .
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是 .
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是 .
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是 .
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO
b.少量CO2通入醋酸钠溶液中:2CH3COO-+CO2+H2O═CO32-+2 CH3COOH
c.过量CO2通入澄清石灰水中:CO2+OH-═HCO3-.
CH3COOH K=1.75×10-5
HClO K=2.95×10-8
H2CO3 K1=4.30×10-7 K2=5.61×10-11
H2SO3 K1=1.54×10-2 K2=1.02×10-7
(1)写出H2CO3的第一级电离平衡常数表达式:K1=
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO
b.少量CO2通入醋酸钠溶液中:2CH3COO-+CO2+H2O═CO32-+2 CH3COOH
c.过量CO2通入澄清石灰水中:CO2+OH-═HCO3-.
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)H2CO3的第一级电离平衡常数表达式K=
;
(2)酸的电离平衡常数越小,该酸的电离程度越小,则其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大;
(3)在醋酸中通入少量HCl,溶液中c(H+)增大,抑制醋酸电离,电离平衡常数只与温度有关;
(4)强酸能和弱酸盐反应生成弱酸,酸性氧化物能和碱反应生成盐和水.
| c(H+).c(HCO3-) |
| c(H2CO3) |
(2)酸的电离平衡常数越小,该酸的电离程度越小,则其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大;
(3)在醋酸中通入少量HCl,溶液中c(H+)增大,抑制醋酸电离,电离平衡常数只与温度有关;
(4)强酸能和弱酸盐反应生成弱酸,酸性氧化物能和碱反应生成盐和水.
解答:
解:(1)H2CO3的第一级电离平衡常数表达式K=
,故答案为:
;
(2)酸的电离平衡常数越小,该酸的电离程度越小,则其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大,根据电离平衡常数知,酸根离子水解程度最大的是CO3 2-,则相同浓度钠盐溶液pH最大的是Na2CO3,故答案为:Na2CO3;
(3)在醋酸中通入少量HCl,溶液中c(H+)增大,抑制醋酸电离,c(CH3COO-)减小,温度不变,醋酸的电离平衡常数不变,故选a;
(4)a.酸性H2CO3>HClO>HCO3-,少量CO2通入次氯酸钠溶液中反应生成碳酸氢钠和次氯酸,离子方程式为:CO2+H2O+ClO-═HCO3-+HClO,故正确;
b.酸性CH3COOH>H2CO3,所以碳酸和醋酸钠不反应,故错误;
c.过量CO2通入澄清石灰水中二者反应生成碳酸氢钙,离子方程式为:CO2+OH-═HCO3-,故正确;
故选b.
| c(H+).c(HCO3-) |
| c(H2CO3) |
| c(H+).c(HCO3-) |
| c(H2CO3) |
(2)酸的电离平衡常数越小,该酸的电离程度越小,则其酸根离子水解程度越大,酸根离子水解程度越大,相同浓度的钠盐溶液的pH越大,根据电离平衡常数知,酸根离子水解程度最大的是CO3 2-,则相同浓度钠盐溶液pH最大的是Na2CO3,故答案为:Na2CO3;
(3)在醋酸中通入少量HCl,溶液中c(H+)增大,抑制醋酸电离,c(CH3COO-)减小,温度不变,醋酸的电离平衡常数不变,故选a;
(4)a.酸性H2CO3>HClO>HCO3-,少量CO2通入次氯酸钠溶液中反应生成碳酸氢钠和次氯酸,离子方程式为:CO2+H2O+ClO-═HCO3-+HClO,故正确;
b.酸性CH3COOH>H2CO3,所以碳酸和醋酸钠不反应,故错误;
c.过量CO2通入澄清石灰水中二者反应生成碳酸氢钙,离子方程式为:CO2+OH-═HCO3-,故正确;
故选b.
点评:本题考查了弱电解质的电离,明确弱酸电离平衡常数与酸性强弱、酸根离子水解程度的关系是解本题关键,注意(3)中电离平衡常数只与温度有关,与溶液浓度无关,为易错点.

练习册系列答案
相关题目
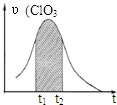 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合 |
| C、后期速率υ下降的主要原因是反应向逆反应方向进行 |
| D、图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量 |
 LiN3与NaN3在军事和汽车安全气囊上有重要应用.
LiN3与NaN3在军事和汽车安全气囊上有重要应用.
