题目内容
19.合理应用和处理氮的化合物,在生产生活中有重要意义.(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)?H=+133.6kJ/mol.该反应的化学平衡常数的表达式K=c2(NH3)•c(CO2).关于该反应的下列说法正确的是a(填序号).
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气.
已知:图1
结合①中信息,尿素还原NO(g)的热化学方程式是2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(l)△H=-1804.7KJ/mol.
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)═CO (NH2)2 (s)+H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图2所示
则a点的正反应速率v正(CO2)>b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是0.75.
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2.已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是2NO2+CO32-=NO3-+NO2-+CO2;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).

分析 (1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
a.混合气体中只有氨气、二氧化碳,二者物质的量之比为定值2:1,平均相对分子质量不变;
b.平衡常数只受温度影响;
c.正反应为吸热反应,降低温度平衡逆向移动;
②尿素在一定条件下可将氮的氧化物还原为氮气,反应方程式为:2 CO(NH2)2(s)+6 NO(g)=5 N2(g)+2CO2(g)+4 H2O(l),
已知:①CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)?△H=+133.6kJ/mol,
由图可得热化学方程式:②4NH3(g)+6 NO(g)=5 N2(g)+6H2O(l)△H=-2071.9 kJ/mol,
根据盖斯定律,①×2+②可得:2 CO(NH2)2(s)+6 NO(g)=5 N2(g)+2CO2(g)+4 H2O(l);
③a点未到达平衡,反应继续向正反应进行,正反应速率减小、逆反应速率增大到b点平衡状态时正逆速率相等;
设NH3和CO2的起始物质的量为1mol,平衡时氨气转化率为x,表示出平衡时各组分物质的量,结合氨气的体积分数20%列方程计算;
(2)9.2gNO2的物质的量为:$\frac{9.2g}{46g/mol}$=0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解溶液呈碱性.
解答 解:(1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出,CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)平衡常数K=c2(NH3)•c(CO2);
a.混合气体中只有氨气、二氧化碳,二者物质的量之比为定值2:1,平均相对分子质量不变,故a正确;
b.平衡常数只受温度影响,温度不变,平衡常数不变,增加水的用量不影响平衡常数,故b错误;
c.正反应为吸热反应,降低温度平衡逆向移动,尿素的转化率减小,故c错误,
故答案为:c2(NH3)•c(CO2);a;
②尿素在一定条件下可将氮的氧化物还原为氮气,反应方程式为:2 CO(NH2)2(s)+6 NO(g)=5 N2(g)+2CO2(g)+4 H2O(l),
已知:①CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)?△H=+133.6kJ/mol,
由图可得热化学方程式:②4NH3(g)+6 NO(g)=5 N2(g)+6H2O(l)△H=-2071.9 kJ/mol,
根据盖斯定律,①×2+②可得:2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(l)△H=-1804.7KJ/mol,
故答案为:2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(l)△H=-1804.7KJ/mol;
③氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率,故v正(CO2)>v逆(CO2);
设NH3和CO2的起始物质的量为1mol,平衡时氨气转化率为x,则:
CO2(g)+2NH3(g)?CO (NH2)2 (s)+H2O(g),
起始量(mol):1 1 0
变化量(mol):0.5x x 0.5x
平衡量(mol):1-0.5x 1-x 0.5x
氨气的体积分数=$\frac{1-x}{2-x}$=20%,解得x=75%,
故答案为:>;75%;
(2)9.2gNO2的物质的量=$\frac{9.2g}{46g/mol}$=0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解溶液呈碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:2NO2+CO32-=NO3-+NO2-+CO2;c(NO3-)>c(NO2-)>c(OH-)>c(H+).
点评 本题考查了化学平衡的计算,题目难度中等,涉及离子浓度大小比较、盖斯定律在热化学方程式计算中的应用、化学平衡计算、化学平衡常数等知识,注意掌握化学平衡及其影响,明确三段式在化学平衡计算中的应用方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

| 步 骤 |  | 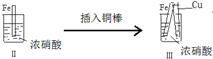 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
| A. | 若x=4,则W的转化率增大 | B. | 若x=3,则W的转化率不变 | ||
| C. | 若W的转化率增大,则x一定等于1 | D. | 缺条件,无法判断 |
 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 的名称是1,3-二甲基苯
的名称是1,3-二甲基苯


 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.