题目内容
19.原子序数介于11-35之间的两种主族元素A、B的离子分别为Am+和Bn-,填写下表| 位置 | A与B相差质子数 | 离子半径比较 | ||||
| 周期 | 主族 | 纵行 | ||||
| Am+与Bn-相差两个电子层 | A | |||||
| B | ||||||
| Am+与Bn-相差一个电子层 | A | |||||
| B | ||||||
| Am+与Bn-电子层结构相同 | A | |||||
| B | ||||||
分析 原子序数介于11-35之间,为第二周期至第四周期元素,Am+与Bn-相差两个电子层,A只能为三周期元素,B为第四周期元素,Am+与Bn-相差一个电子层,A、B可位于周期表相同周期,为第三或第四周期;元素A和B的离子Am+和Bn-它们的核外电子排布相同,即核外电子数相等:ZA-m=ZB+n,根据主族元素族序数=最外层电子数=元素的最高化合价,最高正价与最低负价的绝对值之和等于8,以此解答该题.
解答 解:原子序数介于11-35之间,为第二周期至第四周期元素,
Am+与Bn-相差两个电子层,A只能为三周期元素,B为第四周期元素,A的族序数为m,为m纵行或m+10纵行,B的族序数为8-n,为18-n纵行,A与B的质子数相差26-m-n,离子半径Am+<Bn-;
Am+与Bn-相差一个电子层,A、B可位于周期表相同周期,为第三或第四周期,则A的族序数为m,为m纵行或m+10纵行,B的族序数为8-n,为18-n纵行,A与B的质子数相差8-m-n或18-m-n,离子半径Am+<Bn-;
元素A和B的离子Am+和Bn-它们的核外电子排布相同,即核外电子数相等:ZA-m=ZB+n,A的族序数为m,为m纵行或m+10纵行,B的族序数为8-n,为18-n纵行,A与B的质子数相差m+n,离子半径Am+<Bn-,
故答案为:
| 位置 | A与B相差质子数 | 离子半径比较 | ||||
| 周期 | 主族 | 纵行 | ||||
| Am+与Bn-相差两个电子层 | A | 3 | mA | m或m+10 | 26-m-n | Am+<Bn- |
| B | 3 | (8-n) A | 18-n | |||
| Am+与Bn-相差一个电子层 | A | 3(4) | mA | m或m+10 | 8-m-n或18-m-n | Am+<Bn- |
| B | 3(4) | (8-n) A | 18-n | |||
| Am+与Bn-电子层结构相同 | A | 3 | (8-n) A | 18-n | m+n | Am+<Bn- |
点评 本题考查位置、结构、性质,熟悉原子结构、核电荷数、原子序数、核外电子数的关系即可解答,明确核外电子排布相同是解答本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.在0.1mol•L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,醋酸电离程度增大 |
10.下列关于镁的叙述正确的是( )
| A. | 镁条失火可以用CO2进行扑灭 | B. | 镁不能与稀硫酸反应放出H2 | ||
| C. | 镁制容器可以盛放浓硝酸 | D. | 镁在空气中燃烧产物并不全是MgO |
14.下列物质在水溶液中,存在电离平衡的是( )
| A. | NaOH | B. | CH3COOH | C. | BaSO4 | D. | CH3COONa |
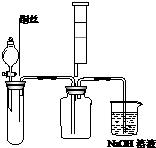 (1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.
(1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.