题目内容
8.某地甲、乙两个工厂排出的废液中都含有污染环境的物质,甲工厂排出的废液中含有一种有毒的盐,使废液呈现蓝色;乙工厂排出的废液中含有一种污染水源的碱.为了防止污染,变废为宝,两厂将排出的废液按一定比例混合,发生化学反应后溶液变成无色.经测定,这种无色溶液中的溶质只有氯化钠.(1)根据以上叙述判断:甲工厂排出的废液中含有的盐是CuCl2;乙工厂排出的废液中含有的碱是NaOH;
(2)两厂排出的废液发生反应的化学反应,生成物除氯化钠外还有Cu(OH)2;
(3)写出两厂废液混合后发生反应的方程式:CuCl2+2NaOH=Cu(OH)2↓+2NaCl.该反应的基本类型属于复分解反应.
分析 (1)根据题中信息,甲厂废液为蓝色,说明含有铜离子;乙厂废液含有碱,说明一定有氢氧根离子;两厂将排出的废液按一定比例混合,发生化学反应后溶液变成无色,这种无色溶液中的溶质只有氯化钠,说明甲乙两厂含有氯离子和钠离子,则甲厂含有氯化铜,乙厂含有氢氧化钠;
(2)根据(1)的推断进行解答;
(3)根据(1)推断可知氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,根据反应判断反应类型.
解答 解:(1)甲厂废液为蓝色,说明含有铜离子;乙厂废液含有碱,说明一定有氢氧根离子;两厂将排出的废液按一定比例混合,发生化学反应后溶液变成无色,这种无色溶液中的溶质只有氯化钠,说明甲乙两厂含有氯离子和钠离子,则甲厂含有CuCl2,乙厂含有NaOH;
故答案为:CuCl2;NaOH;
(2)氯化铜和氢氧化钠反应生成氢氧化铜和氯化钠,两厂排出的废液发生反应的化学反应,生成物除NaCl外还有Cu(OH)2;
故答案为:Cu(OH)2;
(3)两厂废液混合后发生反应的方程式:CuCl2+2NaOH═2NaCl+Cu(OH)2↓,该反应为盐和碱反应生成盐和另一种不溶性碱,属于复分解反应.
故答案为:CuCl2+2NaOH═2NaCl+Cu(OH)2↓;复分解.
点评 本题主要考查了未知物的检验、物质的检验与推断的方法,注意掌握溶液的酸碱性与PH知的关系和盐的化学性质,学会分析反应现象和本质的联系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.原子序数介于11-35之间的两种主族元素A、B的离子分别为Am+和Bn-,填写下表
| 位置 | A与B相差质子数 | 离子半径比较 | ||||
| 周期 | 主族 | 纵行 | ||||
| Am+与Bn-相差两个电子层 | A | |||||
| B | ||||||
| Am+与Bn-相差一个电子层 | A | |||||
| B | ||||||
| Am+与Bn-电子层结构相同 | A | |||||
| B | ||||||
16.将9.0g铜和铁的混合物投入100ml稀硝酸中充分反应得到标况下1.12LNO,剩余4.8g金属,继续加入100ml等浓度的稀硝酸金属完全溶解,又得到标况下1.12LNO.若向反应后的溶液中滴入KSCN溶液不变红,则下列说法正确的是( )
| A. | 第一次与100ml稀硝酸反应剩4.8g金属为Cu和Fe | |
| B. | 反应前稀硝酸的物质的量的浓度为1.5 mol•L-1 | |
| C. | 若向上述最后所得溶液中再加入足量的稀硝酸还可得到标况下0.56LNO | |
| D. | 原混合物中Cu和Fe的物质的量分别为0.06mol和0.09mol |
3.对氨水溶液中存在的电离平衡NH3•H2O?NH4++OH-,下列叙述正确的是( )
| A. | 加入少量NH4Cl固体,平衡逆移溶液中c(NH4+)减小 | |
| B. | 加入少量浓盐酸,浓盐酸与 NH3•H2O反应,电离平衡逆移 | |
| C. | 加热,电离平衡逆移 | |
| D. | 加水后,溶液中n(OH-)增大 |
20.能说明化合物X与Y互为同分异构体的依据是( )
| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
9.氮化硅的强度很高,尤其是热压氮化硅,是世界上最坚硬的物质之一,氮化硅陶瓷可做燃气轮机的燃烧室、机械密封环、输送铝液的电磁泵的管道及阀门、永久性模具、钢水分离环等.制备氮化硅可将硅粉放在氮气中加热至1000℃左右直接氮化制得,实验室制备氮化硅装置示意图如下:
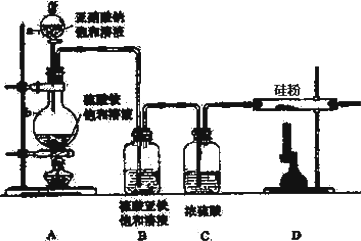
回答下列问题:
(1)a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如右图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
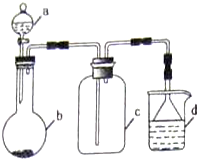

回答下列问题:
(1)a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如右图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D

| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
 .
.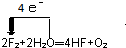 .
.