题目内容
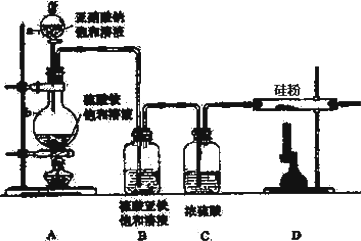
1.工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,它的反应原理可以用下面的方程式表示:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl.以上反应的总结果是放热反应.请设计一个实验:用最简单的实验装置模拟实现这一过程,获得碳酸氢钠晶体.可供选择的实验用品有:6mol/L的盐酸、6mol/L的硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化氨、食盐蒸馏水和冰,以及中学化学实验常用仪器.(1)画出实验装置示意图(包括反应时容器中的物质),并在图中玻璃容器旁自左至右分别用A,B,C等符号标明(请见题后说明).
(2)请写出上图中A,B,C等各玻璃容器中盛放物质的化学式或名称.
(3)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶.
说明:本题装置示意图中的仪器可以用下面的方式表示.

铁架台、石棉网、酒精灯、玻璃导管之间的连接胶管等,在示意图中不必画出,如需要加热,在需要加热的仪器下方,标以“△”表示.
分析 (1)(2)根据题中提供的药品可知,将食盐溶于浓氨水得饱和食盐水及浓氨水的混合溶液,用6mol/L的盐酸与石灰石反应生成CO2,通过蒸馏水除去二氧化碳气体中少量的氯化氢,将除杂后的二氧化碳通入饱和食盐水及浓氨水的混合溶液,为了促使碳酸氢钠的析出,可以将反应容器置于冰水浴中,反应中的尾气中含有氨气,所以可以用6mol/L的硫酸溶液吸收反应中的尾气,据此答题;
(3)根据碳酸氢钠和碳酸氢铵受热分解的产物不同判断是碳酸氢钠还是碳酸氢铵,根据碳酸氢钠、食盐遇盐酸后的现象判断是碳酸氢钠还是食盐.
解答 解:(1)根据题中提供的药品可知,将食盐溶于浓氨水得饱和食盐水及浓氨水的混合溶液,用6mol/L的盐酸与石灰石反应生成CO2,通过蒸馏水除去二氧化碳气体中少量的氯化氢,将除杂后的二氧化碳通入饱和食盐水及浓氨水的混合溶液,为了促使碳酸氢钠的析出,可以将反应容器置于冰水浴中,反应中的尾气中含有氨气,所以可以用6mol/L的硫酸溶液吸收反应中的尾气,根据上面的分析可画出装置图为 ,
,
答: ;
;
(2)结合(1)的分析,上述装置中各物质为A.CaCO3,并由漏斗加入6mol/LHCl;B.蒸馏水(或水);C.冰水(或冷水);D.被氯化钠饱和的浓氨水溶液;E.6mol/LH2SO4,
答:A.CaCO3,并由漏斗加入6mol/LHCl;B.蒸馏水(或水);C.冰水(或冷水);D.被氯化钠饱和的浓氨水溶液;E.6mol/LH2SO4;
(3)根据碳酸氢钠和碳酸氢铵受热分解的产物不同判断是碳酸氢钠还是碳酸氢铵,根据碳酸氢钠、食盐遇盐酸后的现象判断是碳酸氢钠还是食盐,实验操作为取少量产品放在试管中,在酒精灯加热至不再有气体放出时,停止加热.试管中如有白色剩余物质,则得到的产品不是碳酸氢氨,试管冷却后,向其中加入适量盐酸,反应激烈,冒大量气泡,最后剩余物全部溶解,说明得到的结晶是碳酸钠;如果加入盐酸后,晶体全部溶解,但没有气泡产生,则得到的结晶可能是食盐,
答:取少量产品放在试管中,在酒精灯加热至不再有气体放出时,停止加热.试管中如有白色剩余物质,则得到的产品不是碳酸氢氨,试管冷却后,向其中加入适量盐酸,反应激烈,冒大量气泡,最后剩余物全部溶解,说明得到的结晶是碳酸钠;如果加入盐酸后,晶体全部溶解,但没有气泡产生,则得到的结晶可能是食盐.
点评 本题考查了实验过程设计,装置图连接的注意问题和原则方法,实验测定成份等知识,掌握基础是关键,题目难度中等.

| 位置 | A与B相差质子数 | 离子半径比较 | ||||
| 周期 | 主族 | 纵行 | ||||
| Am+与Bn-相差两个电子层 | A | |||||
| B | ||||||
| Am+与Bn-相差一个电子层 | A | |||||
| B | ||||||
| Am+与Bn-电子层结构相同 | A | |||||
| B | ||||||
| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
回答下列问题:
(1)a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如右图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
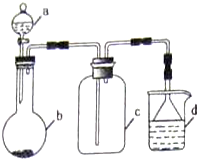
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
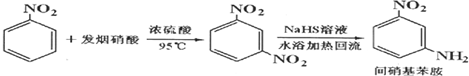
(发烟硝酸是溶有NO2的98%的浓硝酸)
①在圆底烧瓶中加入原料,加热搅拌使充分反应;
②将反应物倒入盛有碎冰的烧杯,待冷却结晶后倾倒出酸液,对剩余混合物进行抽滤;
③将滤出固体溶于甲醇,置于烧瓶中按照图1装置安装,并加入NaHS溶液,加热;
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |
已知:偶极矩可表示分子受固定相吸附的能力,越大吸附力越强请回答下列问题:

(1)步骤①中反应前期加热温度如超过95℃,易造成原料损失,故加热方式应为水浴加热;
(2)步骤②中抽滤的同时需用饱和Na2CO3溶液对固体进行洗涤,目的是洗去产物中混有的酸性物质,简述洗涤的操作过程在布氏漏斗中倒入饱和Na2CO3溶液至浸没固体后抽滤,重复若干次;
(3)步骤③装置(图1)中a仪器名称为干燥管,其中填充有碱石灰,作用是吸收挥发出的硝酸、NO2等酸性物质;
(4)关于步骤④装置(图2)相关叙述错误的是BCD;
A.冷凝水流向错误,应为低流进高流出
B.锥形瓶中首先收集到的液体为蒸馏水
C.温度计水银球位置偏低,应在液面以上,紧贴液面以迅速测定气体组分的温度
D.图1、2装置中b、c均有冷凝效果,故步骤④可在图1装置中直接完成蒸馏,无需改为图2装置
(5)最终得到的产品中含有少量邻硝基苯胺、对硝基苯胺以及硝基苯杂质,根据固定相对各组分在流动过程中的吸附能力大小可混合物分离.图3所示为混合物,已知C为间硝基苯胺,写出B的结构简式
 ;
;(6)之后该同学设计的提纯装置如图4:在一根底部带有旋塞的玻璃管内装满固定相,将流动相与样品混合后从上端倒入,并持续倒入流动相,一段时间后发现管内出现如图四段黄色色带,则本实验所需收集的产物组分主要集中在色带层② (填编号)上.
| A. | 2.2×10-10 mol/L | B. | 2.2×10-12 mol/L | C. | 2.2×10-14 mol/L | D. | 1.1×10-21 mol/L |
| A. | 纯水 | B. | 稀硫酸 | C. | 氯化钡溶液 | D. | 硫酸钠溶液 |
 .
.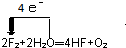 .
.
 .
.