题目内容
肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和液态H2O,放出19.5kJ热量(25℃时),写N2H4燃烧的热化学方程式 .
考点:热化学方程式
专题:
分析:1mol肼质量为32克,完全燃烧生成液态水放出19.5kJ×32=624kJ热量,据此书写热化学反应方程式.
解答:
解:1mol肼完全燃烧生成液态水放出19.5kJ×32=624kJ热量,该热化学反应方程式为N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-624kJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624 kJ?mol-1.
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624 kJ?mol-1.
点评:本题考查了热化学方程式书写,题目难度中等.

练习册系列答案
相关题目
向溴化铁溶液中加入足量新制氯水,将溶液蒸干并充分灼烧,最后得到的固体是( )
| A、Fe2O3 |
| B、FeCl3 |
| C、FeCl3和Br2 |
| D、Fe(OH)3 |
下列关于金属元素特征的叙述正确的是( )
| A、金属元素的原子只有还原性,离子只有氧化性 |
| B、金属单质在常温下均是固体 |
| C、金属元素能存在于阳离子中,而不能存在于阴离子中 |
| D、金属元素在化合物中一定显正价 |
2011年9 月29日,“长征-2F”运载火箭成功将“天宫一号”目标飞行器送上太空,火箭中使用的燃料是偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4).在火箭升空过程中,燃料发生反应:CH3-NH-NH-CH3+2N2O4→2CO2+3N2+4H2O提供能量.下列叙述正确的是( )
| A、该燃料绿色环保,在燃烧过程中不会造成任何环境污染 |
| B、该反应中N2O4是氧化剂,偏二甲肼是还原剂 |
| C、CO2是氧化产物,N2是还原产物 |
| D、每有0.6 mol N2生成,转移电子数目为2.4NA |
下列说法中正确的是( )
| A、HCHO分子中既含σ键又含π键 |
| B、CO2分子中的化学键为非极性键 |
| C、NH3分子中N原子的杂化轨道类型是sp2 |
| D、沸点:HF>NH3>H2O |
以NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A、3.4gNH3中含N-H键数目为0.2NA |
| B、14 g乙烯和丙烯的混合物中总原子数为3NA |
| C、2.24LCO2与足量的Na2O2反应,反应中转移的电子总数为0.1NA |
| D、理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外电路通过电子数为NA |
 X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.
X、Y、Z、W四种常见元素,且均为短周期元素.已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧.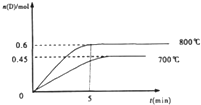 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题: Ⅰ.下列有关仪器的使用,能实现的是
Ⅰ.下列有关仪器的使用,能实现的是