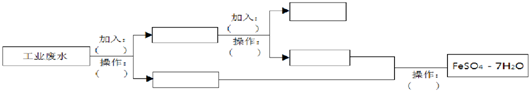
题目内容
19.含有5.418×1023个质子的OH-的物质的量为0.9mol.分析 1个OH-含有9个质子,结合n=$\frac{N}{{N}_{A}}$计算.
解答 解:1个OH-含有9个质子,则含有5.418×1023个质子的OH-的物质的量为$\frac{5.418×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.9mol,
故答案为:0.9.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成及物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.欲除去小苏打溶液中的苏打杂质,加入的物质最宜选用( )
| A. | 二氧化碳 | B. | 盐酸 | C. | 碳酸氢钙 | D. | 氢氧化钙 |
14.现有6瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖中的一种.现通过如下实验来确定各试剂瓶中所装液体的名称:
(1)A的俗名为酒精,B中所含官能团的名称为羧基. D的结构简式为CH3COOCH2CH3.
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
11.下列关于阿伏伽德罗常数的叙述不正确的是( )
| A. | 阿伏伽德罗常数是指1mol物质中所含有的原子数 | |
| B. | 微粒的数目与物质的量成正比 | |
| C. | 国际上规定0.012kg12C中所含碳原子数为阿伏伽德罗常数 | |
| D. | 1mol O2中的分子数为NA,而原子数为2NA |
8.化工生产中用烷烃和氧气或水蒸气反应可得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨.对甲烷而言,有以下两个主要反应:
①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g);△H1=-36kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
(1)反应②中参加反应的CH4(g)与H2O(g)的总能量小于(填“大于”、“小于”或“等于”)生成的CO(g)与H2(g)的总能量.
(2)若氧气和水蒸气的混合气体中氧气的物质的量分数为x,请填写下列空白.
①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g);△H1=-36kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
(1)反应②中参加反应的CH4(g)与H2O(g)的总能量小于(填“大于”、“小于”或“等于”)生成的CO(g)与H2(g)的总能量.
(2)若氧气和水蒸气的混合气体中氧气的物质的量分数为x,请填写下列空白.
| 序号 | x(O2) | 与O2反应的 (Q1/kJ) | 与H2O反应的 (Q2/kJ) | 总反应的 (Q3/kJ) |
| I | 0.2 | -18 | ||
| Ⅱ | -36 | +72 |