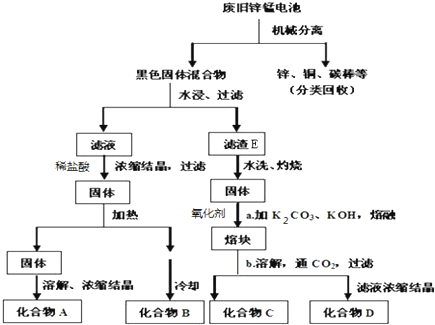
题目内容
9.“氢能”是未来最理想的新能源.(1)有下列3个反应:
①3FeCl2+4H2O$\frac{\underline{\;500℃\;}}{\;}$Fe3O4+6HCl+H2;
②Fe3O4+$\frac{3}{2}$Cl2+6HCl$\frac{\underline{\;100℃\;}}{\;}$3FeCl3+3H2O+$\frac{1}{2}$O2;
③3FeCl3$\frac{\underline{\;300℃\;}}{\;}$3FeCl2+$\frac{3}{2}$Cl2↑
这3个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是H2;
(2)利用核能把水分解制氢气,是目前正在研究的课题,如图所示是其中的一种流程,其中用了过量的碘.

完成下列反应的化学方程式:反应①SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$H2SO4+2HI,反应②2H2SO4═2SO2↑+O2↑+2H2O,此法制取氢气的最大优点是SO2和I2循环使用,避免了污染环境.
分析 (1)根据盖斯定律,由①+②+③可得;
(2)根据反应①②写出反应化学方程式,根据制备氢气的过程使用的物质、能量的消耗、环境的污染污染等方面进行分析.
解答 解:(1)①3FeCl2+4H2O$\frac{\underline{\;500℃\;}}{\;}$Fe3O4+6HCl+H2;
②Fe3O4+$\frac{3}{2}$Cl2+6HCl$\frac{\underline{\;100℃\;}}{\;}$3FeCl3+3H2O+$\frac{1}{2}$O2;
③3FeCl3$\frac{\underline{\;300℃\;}}{\;}$3FeCl2+$\frac{3}{2}$Cl2↑
根据盖斯定律,由①+②+③可得:H2O$\frac{\underline{\;△\;}}{\;}$$\frac{1}{2}$O2+H2,氧气具有助燃性,而氢气具有可燃性,则主要用来生产能解决环境和能源问题的某种气体为H2;
故答案为:H2;
(2)由制备氢气的过程可知,反应①发生的反应是:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$H2SO4+2HI,反应②是H2SO4分解为了SO2、O2和H2O,故发生的反应为:2H2SO4═2SO2↑+O2↑+2H2O,用该法制取氢气最大的优点是:SO2和I2循环使用,避免了污染环境;
故答为:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$H2SO4+2HI;2H2SO4═2SO2↑+O2↑+2H2O;SO2和I2循环使用,避免了污染环境.
点评 本题主要考查盖斯定律的应用和新能源的利用,把握已知反应和流程图为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

| A. | H2S属于非电解质 | B. | NO和CO都属于酸性氧化物 | ||
| C. | H2S只有还原性没有氧化性 | D. | H2S、NO和CO都能与臭氧反应 |
| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.

(1)配平制备ClO2的化学方程式:2KClO3+1H2C2O4--2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4、0.1mol•L-1 HCl、0.01mol•L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |

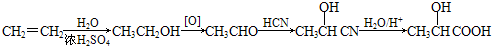
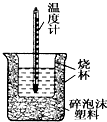 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: