题目内容
10.某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实方案.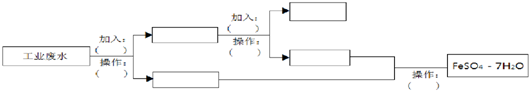
分析 工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,先加过量铁,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,结合流程可知,第一步操作为过滤,过滤出Cu,Fe,滤液是FeSO4,Cu、Fe中加入H2SO4,铁与硫酸反应,铜不反应,第二步操作为过滤,得到Cu,滤液中主要含FeSO4,第三步操作为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,以此来解答.
解答 解:工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,根据流程图中可以知道,完成回收硫酸亚铁和铜,先加过量铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,分离固体和液体用过滤,过滤,废水中剩下FeSO4和少量的Na+,铁与硫酸反应,与铜不反应,铁粉、铜中加H2SO4,Fe+H2SO4=FeSO4+H2↑,得到FeSO4,第三步操作为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,简单方案具体如下: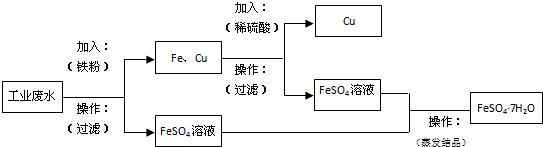 ,
,
故答案为: .
.
点评 本题考查回收硫酸亚铁和铜的实方案设计,题目难度中等,注意根据物质的性质选择分离提纯的方法,特别是过滤和蒸发结晶操作,注意把握所使用仪器和操作步骤.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.两气体A和B的摩尔质量之比为3:1,则它们在同温、同压、同体积时的分子个数比应为( )
| A. | 1:1 | B. | 1:3 | C. | 3:1 | D. | 9:1 |
5.下列叙述正确的是( )
| A. | 阿伏加德罗常数就是6.02×1023 | |
| B. | 物质的量是一物理量,表示含有一定数目粒子的集体 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 摩尔既是物质的量的单位,又是粒子的数量单位 |
15.下列各项叙述中,正确的是( )
| A. | H2O分子的中心原子形成sp2杂化轨道 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
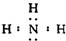 ,化学键类型为共价键;
,化学键类型为共价键;